
题目列表(包括答案和解析)
化学兴趣小组利用废烧碱(含少量Na2CO3、NaCl、MgCl2、CaCl2等)制Na2CO3·10H2O。
【制取流程】
【相关资料】①Na2CO3+H2O+CO2=2NaHCO3 ②2NaHCO3 Na2CO3+H2O+CO2↑
②2NaHCO3 Na2CO3+H2O+CO2↑
③在NaHCO3溶液中加入BaCl2溶液,可发生如下反应:
2NaHCO3+BaCl2=BaCO3↓+2NaCl+ H2O+CO2↑
④碳酸钠的饱和溶液在不同温度下析出的晶体如下图所示:
【问题讨论】
(1)滤渣主要成分为Mg(OH)2和 ,产生Mg(OH)2的化学方程式 。
(2)操作Ⅰ需使用的玻璃仪器有:烧杯、 和玻璃棒。
(3)取少量溶液B,加入BaCl2溶液,充分混合,若观察到 (填现象),则溶液B中含NaHCO3。
(4)结晶后,过滤时的温度须低于 ℃。
(5)“母液”不能沿流程中虚线路径循环使用,原因是 (选填序号)。
①“母液”不含Na2CO3 ② “母液”多次循环后,NaCl含量增加
【组成确定】
(6)取少量的粗产品,加水溶解,加足量 (选取数字序号,下同),充分搅拌,再加少量 ,无沉淀,证明其中不含NaCl。
①AgNO3溶液 ②稀盐酸 ③稀硝酸
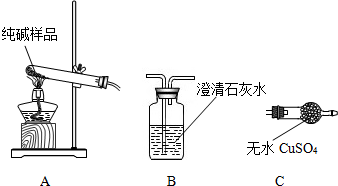
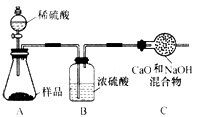
(7)兴趣小组同学取32.8g干燥粗产品,用如图所示装置(夹持仪器省略)进行实验
查阅资料1:Na2CO3?10H2O加热至32℃,开始分解失水,充分加热可以完全失水;
NaHCO350℃时开始分解,270℃完全分解,Na2CO3受热不分解
查阅资料2:Ba(OH)2溶液能吸收CO2,Ba(OH)2+CO2=BaCO3↓+H2O
①实验前先要 ,再装入粗产品,装置A的作用是 。
②粗产品加热至270℃,据 (填装置编号及现象),可知粗产品中含 。

 ②2NaHCO3 Na2CO3+H2O+CO2↑
②2NaHCO3 Na2CO3+H2O+CO2↑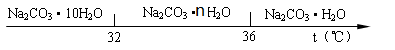

 NH3↑+HCl↑.
NH3↑+HCl↑.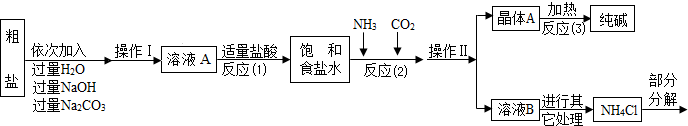
| 选择的装置 | 实验现象 | 实验结论 |
| ______ | ______ | 样品不含晶体A |
|
某校化学兴趣小组参观制碱厂后获得以下信息,并对相关问题进行研究。 | ||||||
 | ||||||
| 上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH==Mg(OH)2↓ +2NaCl;Na2CO3+CaCl2==CaCO3↓+2NaCl;NH4Cl==NH3↑+HCl↑。生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl(饱和溶液)+NH3+CO2+H2O==NaHCO3(晶体)↓+NH4Cl4分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为______________________________________________。 【问题讨论】(2)溶液A中的溶质为________,操作Ⅱ的名称为_____________。 (3)上述生产流程中可循环使用的是____ (填序号)。 A.CO2;B.NH3;C.HCl;D.NaOH;E.Na2CO3 (4)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠: | ||||||
| ||||||
|
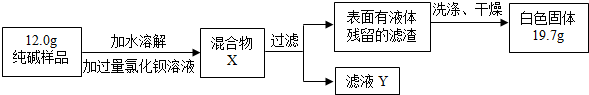
【含量测定】同学们为了测定该纯碱样品的纯度,设计了如下实验。 | ||||||
 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com