气体的实验室制法是一种重要的实验基本技能,请回顾二氧化碳的实验室制法,回答下列问题:
(1)化学反应能生成二氧化碳的反应很多,如见下面反应
①C+O
2CO
2
②Na
2CO
3+2HCl=2NaCl+H
20+CO
2↑
③CaCO
3+2HCl=2CaCl
2+H
20+CO
2↑
④CaC
2O
4CaO+CO↑+CO
2↑
⑤CO+Fe
2O
32Fe+3CO
2
…
请任意分析上面一个不适合于实验制取二氧化碳的反应的原因:
反应②Na2CO3+2HCl═2NaCl+H20+CO2↑该反应速率太快,不利于收集
反应②Na2CO3+2HCl═2NaCl+H20+CO2↑该反应速率太快,不利于收集
.现提供有①纯净的CaCO
3白色粉末,②大理石,③稀盐酸,③浓盐酸,④稀硫酸,⑤浓硫酸.其中最适合用于实验室制取二氧化碳的药品是
②③
②③
(填代号)
(2)盐酸密度(20℃时)和其溶质质量分数之间的关系
| 密度(ρ)/g?ml-1 |
1.00 |
1.02 |
1.04 |
1.06 |
1.08 |
1.10 |
1.12 |
1.14 |
1.16 |
1.185 |
| 溶质质量分数(w)/% |
0.4 |
4.4 |
8.5 |
12.5 |
16.5 |
20.4 |
24.2 |
28.2 |
32.2 |
37.2 |
①分析上述数据可得到一个结论:
溶液质量分数越大,其密度也越大
溶液质量分数越大,其密度也越大
;盐酸是氯化氢气体溶于水得到的溶液,升高盐酸溶液的温度,其密度将变
减小
减小
.
②现要配制200ml溶质质量分数为8.5%的稀盐酸用于制取二氧化碳,则需要溶质质量分数为37.2%的浓盐酸
40.1mL
40.1mL
ml.配制过程中要用到量筒、
胶头滴管
胶头滴管
、烧杯、玻璃棒等仪器.
(3)下面是二氧化碳的制取、净化、收集和量气的相关实验
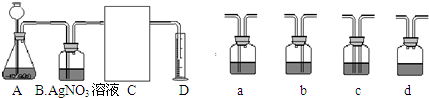
(温馨提示:C装置中装饱和碳酸氢钠溶液,二氧化碳不溶于饱和碳酸氢钠溶液)
①A中的长颈漏斗如果用分液漏斗代替的好处是
分液漏斗比长颈漏斗能更方便的控制反应速率
分液漏斗比长颈漏斗能更方便的控制反应速率
②实验过程B装置产生的主要实验现象是:
产生白色沉淀
产生白色沉淀
;
涉及化学反应是
AgNO3+HC═lAgCl↓+HNO3
AgNO3+HC═lAgCl↓+HNO3
.
③方线框中的C装置应该选择上面提供的a、b、c、d的
a
a
.


