
题目列表(包括答案和解析)
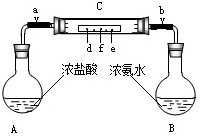 如图所示,烧瓶A中装的是浓盐酸,烧瓶B中装的是浓氨水,长玻璃管C中间有一张滤纸条,每隔1.5cm~2cm滴有一滴紫色石蕊试液,实验前关闭开关a、b,实验开始时打开开关a、b,看到滤纸大部分变蓝色,在玻璃管左端出现大量白烟.请回答下列问题(提示:HCl与NH3相遇,生成NH4Cl固体产生白烟).
如图所示,烧瓶A中装的是浓盐酸,烧瓶B中装的是浓氨水,长玻璃管C中间有一张滤纸条,每隔1.5cm~2cm滴有一滴紫色石蕊试液,实验前关闭开关a、b,实验开始时打开开关a、b,看到滤纸大部分变蓝色,在玻璃管左端出现大量白烟.请回答下列问题(提示:HCl与NH3相遇,生成NH4Cl固体产生白烟).
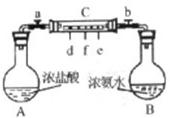 16、如图所示,烧瓶A中装的是浓盐酸,烧瓶B中装的是浓氨水,长玻璃管C中间有一张滤纸条,每隔1.5cm~2cm滴有一滴紫色石蕊试液,实验前关闭开关a、b,实验开始时打开开关a、b,看到滤纸大部分变蓝色,在玻璃管左端出现大量白烟.请回答下列问题(提示:HCl与NH3相遇,生成NH4Cl固体产生白烟).
16、如图所示,烧瓶A中装的是浓盐酸,烧瓶B中装的是浓氨水,长玻璃管C中间有一张滤纸条,每隔1.5cm~2cm滴有一滴紫色石蕊试液,实验前关闭开关a、b,实验开始时打开开关a、b,看到滤纸大部分变蓝色,在玻璃管左端出现大量白烟.请回答下列问题(提示:HCl与NH3相遇,生成NH4Cl固体产生白烟).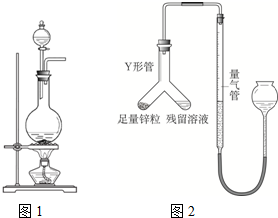 实验室常用MnO2与浓盐酸反应制备Cl2,其反应方程式为:
实验室常用MnO2与浓盐酸反应制备Cl2,其反应方程式为:
| ||
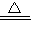 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O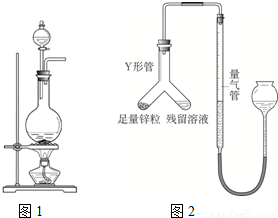
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com