
题目列表(包括答案和解析)
水和溶液在生命活动和生活中起着十分重要的作用。根据下面的溶解度表与溶解度曲线,回答下列问题:

|
温度/°C 溶解度/g |
0 |
20 |
40 |
60 |
80 |
|
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
|
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
|
Ca(OH)2 |
0.173 |
0.165 |
0.121 |
0.116 |
0.094 |
(1)A是 的溶解度曲线。
(2)若用溶质质量分数为10%的NaCl溶液来配制100g溶质质量分数为0.9%的氯化钠溶液,需加水 g。
(3)硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是 。
(4)60℃时,向两个分别盛有50g NaCl和KNO3的烧杯中,各加入100g的水,充分溶解后为饱和溶液的是 溶液;将上述烧杯中剩余固体全部溶解,变为不饱和溶液,下列方法能实现的是 (填序号)。
A.升温 B.加入该溶质 C.加入适量水
D.降温 E.加入足量该溶质的不饱和溶液
(5)如右图所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,原因是 。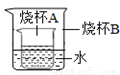
| |||||||||||||||||||||||||||||||||
烧碱(NaOH)是一种重要的化工原料,广泛应用于肥皂、造纸等工业。下面有一些关于烧碱的问题,请按要求解答:
(1)烧碱在工业上通常用电解饱和NaCl水溶液的方法制取,产物除烧碱外,还有H2和Cl2,请写出电解饱和NaCl水溶液的化学方程式 。(2)烧碱放在空气中会变质生成碳酸钠。现有14.6 g暴露在空气中的烧碱样品,全部溶于水,然后滴加足量Ca(OH)2溶液,充分反应后,过滤,烘干得10 g沉淀,则样品的组成为
A.全部为Na2CO3
B.4 g NaCO3和10.6 g NaOH
C.全部为NaOH
D.4 g NaOH和10.6 g Na2CO3
(3)酸碱中和反应在工农业生产和科研上具有很大用途,但氢氧化钠溶液和盐酸反应时看不到明显现象,请你设计一个实验,通过观察到的明显现象,说明氢氧化钠溶液与盐酸发生了反应。
(4)若中和反应需要60 g 10%的NaOH溶液,现提供50g 20%的NaOH溶液、40 g 5%的NaOH溶液以及足够的NaOH固体和水,请选用以上提供的药品设计两种配制方案(只要说明配制所需的各种药品用量)填入下表中。
| 序号 | 配制方案 |
| 举例 | 6 g NaOH固体和54 g水 |
| 方案1 | |
| 方案2 |
(5)下图是某学生用氢氧化钠固体和水配制60 g10%NaOH溶液的部分操作过程,该同学在称量氢氧化钠时,先在两个托盘上各放一张质量相同的纸,然后把药品直接放在纸上称量。

①a操作中的错误是 。
②下列操作中导致溶质质量分数偏低的是 (填字母)。
A.a操作中砝码和氢氧化钠放错盘
B.b中烧杯用水洗涤后未干燥就使用
C.c操作中平视量筒凹液面最低处读数为50 mL
D.d操作中有少量水溅出
(10武汉33).(6分)某化学活动小组用稀盐酸对赤铁矿Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液。为防止直接排放造成环境污染,对其组成进一步进行探究。过滤该残液,取100 g 滤液,向基中不断加入5%和氢氧化钠溶液,所得实验数据如下表:
| 加入氢氧化钠的溶液的质量/g | 20 | 40 | 60 | 80 | 160 | 180 |
| 生成沉淀的质量/g | 0 |
0 | 0.80 | 1.78 | 5.35 | 5.35 |
(1)通过对上述实验数据的分析,该滤液中含有的溶质是--------------(写化学式)。
(2)选择合理的数据,计算100 g 滤液中溶质的质量(若有多种溶质,任选一种。结果精确到0.01g)。可能用到的相对原子质量:H—1 O—16 Na —23 Cl—35.5 Fe —56
(10武汉33).(6分)某化学活动小组用稀盐酸对赤铁矿Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液。为防止直接排放造成环境污染,对其组成进一步进行探究。过滤该残液,取100 g 滤液,向基中不断加入5%和氢氧化钠溶液,所得实验数据如下表:
|
加入氢氧化钠的溶液的质量/g |
20 |
40 |
60 |
80 |
160 |
180 |
|
生成沉淀的质量/g |
0 |
0 |
0.80 |
1.78 |
5.35 |
5.35 |
(1)通过对上述实验数据的分析,该滤液中含有的溶质是--------------(写化学式)。
(2)选择合理的数据,计算100 g 滤液中溶质的质量(若有多种溶质,任选一种。结果精确到0.01g)。可能用到的相对原子质量:H—1 O—16 Na —23 Cl—35.5 Fe —56
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com