
题目列表(包括答案和解析)
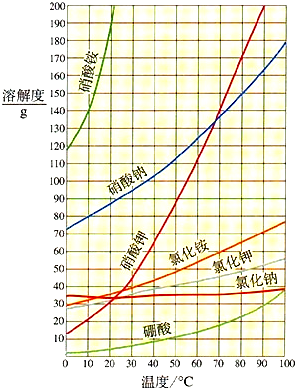 126g溶质质量分数为10%的硝酸溶液与91g氢氧化钠溶液恰好完全反应,试计算:
126g溶质质量分数为10%的硝酸溶液与91g氢氧化钠溶液恰好完全反应,试计算:| 质量分数 | 10% | 20% | 30% | 40% | 50% | 60% | 70% | 80% | 90% | 98% |
| 密度(g/mL) | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.81 | 1.84 |
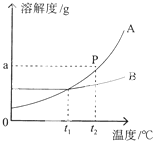 溶液在生产和科研中具有广泛的用途,与人们的生活密不可分.
溶液在生产和科研中具有广泛的用途,与人们的生活密不可分.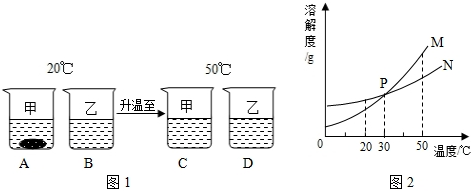
| 溶质的质量分数/% | 4 | 12 | 16 | 24 | 28 |
| 硫酸溶液的密度/g/mL | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度/g/mL | 0.98 | 0.95 | 0.94 | 0.91 | 0.90 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com