
题目列表(包括答案和解析)
水和溶液在生命活动和生产、生活中起着十分重要的作用.
(1)为了防止水的污染,下列做法中,有利于保护水资源的是 (填序号).
①抑制水中所有动、植物生长; ②不任意排放工业废水;
③大量使用化肥农药; ④生活污水经过净化处理后再排放.
(2)从组成角度看:水是由 组成的.
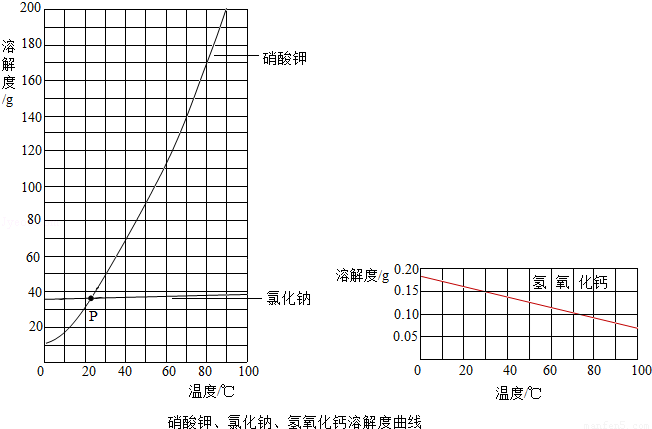
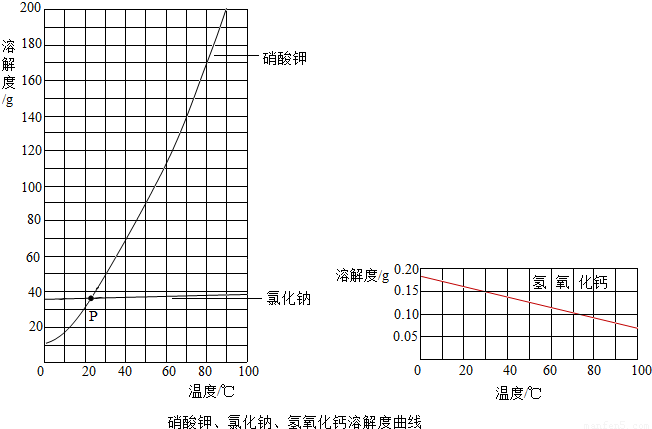
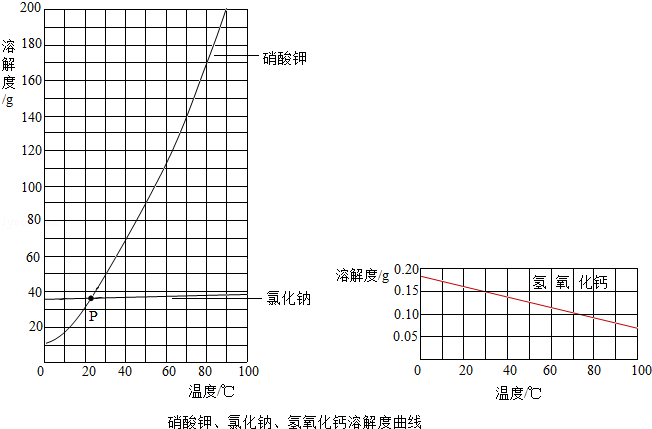
(3)根据上图,回答问题.
①交点P的含义是 .
②随温度升高,氢氧化钙溶解度的变化趋势是 .
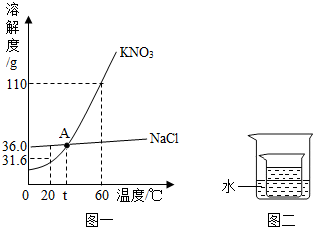
③如下图所示,小烧杯中分别取等质量的三种物质的饱和溶液,分别放入装有等质量水的大烧杯中,若向大烧杯中的水(室温)中加入等质量的硝酸铵使之充分溶解.
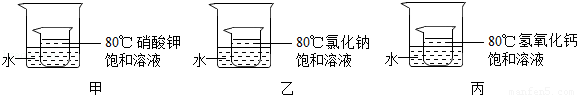
下列关于该实验的说法中,正确的是 (填字母序号).
A.甲、乙的小烧杯中有晶体析出,丙的小烧杯中变浑浊
B.整个过程中,三只小烧杯中溶剂的质量不变
C.80℃时,硝酸钾溶液的浓度一定大于氯化钠溶液的浓度
D.整个过程中,三种物质的溶液均为饱和溶液.
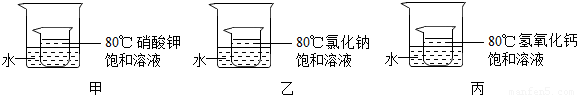

| A.甲、乙的小烧杯中有晶体析出,丙的小烧杯中变浑浊 |
| B.整个过程中,三只小烧杯中溶剂的质量不变 |
| C.80℃时,硝酸钾溶液的浓度一定大于氯化钠溶液的浓度 |
| D.整个过程中,三种物质的溶液均为饱和溶液. |
| ||
| ||

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.8 |
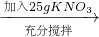 a
a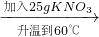
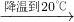 c
c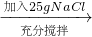 d
d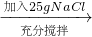 e
e f
f湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com