
题目列表(包括答案和解析)
 已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去.现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质.
已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去.现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质.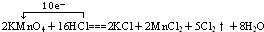
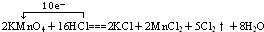
 右图为某市售盐酸试剂瓶标签上的部分数据.通过计算回答:
右图为某市售盐酸试剂瓶标签上的部分数据.通过计算回答:(8分)在反应2KMnO4+16HCl==2KCl+2MnCl2+5Cl2+8H2O中:
氧化剂是 氧化产物是 氧化产物与还原产物的物质的量之比为
被氧化与未被氧化的HCl的质量之比为 ,若有73克HCl被氧化,电子转移的总数为 ,标准状况下生成Cl2的体积为 L.用单线桥标出电子转移的方向和数目
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com