
题目列表(包括答案和解析)
|
铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
经由计算分析,下列推断正确的是 | |
| [ ] | |
A. |
①中溶解了5.6 g Fe |
B. |
硝酸的浓度为4 mol/L |
C. |
②中溶解了9.6 g Cu |
D. |
④中V=6720 |
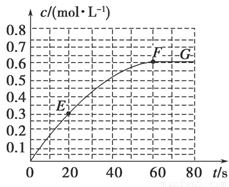
298 K时,某容积固定为1 L的密闭容器中发生如下可逆反应:A(g) 2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
试回答下列问题。
(1)已知298 K时60 s达到平衡,比较40~60 s内和60~80s内B的平均反应速率:v(40~60) v(60~80)(填“﹥”或“﹦”或“﹤”)。
(2)若298 K达到平衡时,B的平衡浓度为A的3倍,共放出热量x kJ,开始加入A的物质的量是 mol。
(3)298k时,该反应的平衡常数为 mol/L。
(4)若反应在298 K进行,在1 L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡时共吸收热量y kJ,此时B的转化率为 (填序号)。
A.等于60% B.等于40%
C.小于40% D.介于40%~60%之间
(5)结合(2)、(4)相关数据,写出a、x、y三者的等式关系式: 。
(6)若反应在298K进行,反应起始浓度为c(A)=c(B)=1.0mol/L,则化学平衡将 (填“正向”“逆向”或“不”)移动。
(7)已知曲线上任意两点之间连线的斜率表示该时间段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),则曲线上任意一点的切线斜率的意义是 。
 用中和滴定法测定某烧碱的浓度.请回答主要操作过程中的有关问题:
用中和滴定法测定某烧碱的浓度.请回答主要操作过程中的有关问题:| 滴定序号 | 待测溶液体积(单位:mL) | 所消耗盐酸体积(单位:mL) | ||
| 滴定前读数 | 滴定后读数 | 消耗盐酸体积 | ||
| 1 | 20.00 | 0.50 | 20.60 | V |
| 2 | 20.00 | 6.10 | 26.00 | |
(12分)已知2X2(g)+Y2(g) 2Z(g) ΔH=-a kJ·mol–1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2,在500℃时充分反应达平衡后Z的浓度为W mol·L–1,放出热量b kJ。
(1)此反应平衡常数表达式为 ;若将温度降低到300℃,则反应平衡常数将 (填增大、减少或不变)
(2)若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度
____W mol·L–1(填“>”、“<”或“=”),a、b、c之间满足关系 (用代数式表示)
(3)能说明反应已达平衡状态的是
A.浓度c(Z)=2c(Y2) B.容器内压强保持不变
C.v逆(X2)=2v正(Y2) D.容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2 mol X2和1mol Y2达到平衡后,Y2的转化率将 (填变大、变小或不变)
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
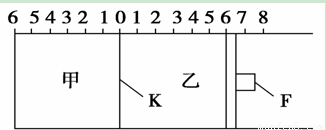
(1)若固定隔板K,能表示甲容器中一定达到化学平衡的是
A.甲中气体的总压强不变 B.各气体的物质的量浓度不变
C.混合气体的平均摩尔质量不变 D.混合气体的密度不变
E.反应速率v(SO2)=v(SO3)
(2)达到平衡后隔板K是否可能处于0刻度 ________(填“可能”或“不可能”)。若K最终停留在0刻度左侧a处,则a一定小于________。
(3)若平衡时,K最终停留在左侧刻度1处,则甲中SO3的物质的量为________mol,乙中SO3的转化率________50%(填“>”、“<”或“=”),活塞F最终停留在右侧刻度______处(填下列序号:①<6 ②>6 ③=6)。
(4)若一开始就将K、F固定,其他条件均不变,甲平衡后压强变为开始压强的0.8倍,则甲、乙都达到平衡后,两容器的压强之比为P甲:P乙=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com