(2008?东台市模拟)某化学学习小组的同学为了探究氢氧化钠溶液与稀盐酸是否恰好完全反应,做了如图所示的实验:
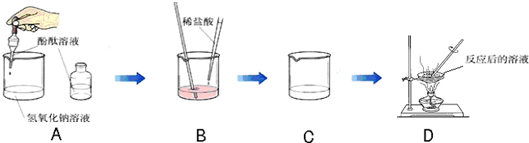
(1)实验中酚酞溶液的作用是
指示氢氧化钠与盐酸何时恰好完全反应③.
指示氢氧化钠与盐酸何时恰好完全反应③.
.
(2)用胶头滴管吸取盐酸加入烧杯中,当溶液刚好
溶液由红色变成无色
溶液由红色变成无色
,停止加入盐酸,该反应的化学方程式为
NaOH+HCl═NaCl+H2O
NaOH+HCl═NaCl+H2O
.
(3)在实验B中某同学欲探究氢氧化钠和稀盐酸反应是否放出热量,实验时用氢氧化钠溶液而不用氢氧化钠固体的原因是
氢氧化钠固体溶于水也放出大量的热
氢氧化钠固体溶于水也放出大量的热
.
(4)上述反应又叫中和反应,中和反应在生活中有广泛的应用,请举一例:
医疗上胃酸过多的病人服用氢氧化铝或农业上用熟石灰改良酸性土壤等
医疗上胃酸过多的病人服用氢氧化铝或农业上用熟石灰改良酸性土壤等
.
(5)如果经测定,蒸发得到的固体中含有CaCl
2(其溶液为中性),那么原NaOH溶液(假定盐酸纯净)中可能混有的杂质是(任写一种杂质的化学式)
Ca(OH)2(或CaCl2)
Ca(OH)2(或CaCl2)
.
同学们为了尝试测定上述食盐(含杂质CaCl
2)的质量分数并提纯,做了如下实验.请根据实验回答有关问题:
①准确称取10g固体样品,溶于适量蒸馏水中,再加入过量的下列某溶液,反应后过滤,得沉淀物1g.加入的某溶液是
C
C
(填编号).
A.NaOH B.K
2CO
3 C.Na
2CO
3 D.HCl(稀)
②往滤液中加入过量的稀盐酸,加入过量稀盐酸的原因是
将滤液中过量的Na2CO3完全除去,以便蒸发后得到纯净的食盐
将滤液中过量的Na2CO3完全除去,以便蒸发后得到纯净的食盐
.
③将加入稀盐酸后的滤液放在蒸发皿里加热蒸发.加热过程中,要用玻璃棒不断搅拌,其作用是
使液体受热均匀,防止液滴飞溅
使液体受热均匀,防止液滴飞溅
.

