
题目列表(包括答案和解析)
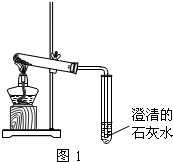 含钠元素、钙元素的化合物是初中化学的重要研究对象之一.
含钠元素、钙元素的化合物是初中化学的重要研究对象之一.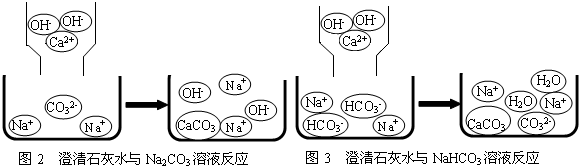
| 实验内容 | 实验现象 | 实验结论 |
| 方案一:取少量滤液加入试 管中,向其中 |
娇娇同学的猜想是正确的. 滤液中含有的两种溶质是 | |
| 方案二:取少量滤液加入试管中,向其中 |
 学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议
学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议 含钠元素、钙元素的化合物是初中化学的重要研究对象之一.
含钠元素、钙元素的化合物是初中化学的重要研究对象之一.
| 实验内容 | 实验现象 | 实验结论 |
| 方案一:取少量滤液加入试 管中,向其中______ | ______ | 娇娇同学的猜想是正确的. 滤液中含有的两种溶质是 ______ |
| 方案二:取少量滤液加入试管中,向其中______ | ______ |
 学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议______
学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议______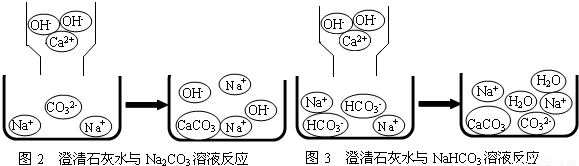
| 实验内容 | 实验现象 | 实验结论 |
| 方案一:取少量滤液加入试 管中,向其中______ | ______ | 娇娇同学的猜想是正确的. 滤液中含有的两种溶质是 ______ |
| 方案二:取少量滤液加入试管中,向其中______ | ______ |
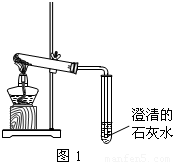
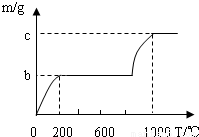
由Fe、S、O、H四种元素中的两种或三种元素组成四种常见的化合物.其中甲能跟氯化钡反应生成一种硫酸盐和另一种盐;乙能跟氢氧化钠反应生成盐和水;丙能跟盐酸反应生成盐和水;丁呈中性,且可分别跟氧化钙或二氧化碳发生反应,生成相应的碱或酸.下列推断:①甲一定是硫酸铁;②乙不一定是硫酸;③丙一定是氢氧化铁;④丁一定是水.其中正确的是
①④
②④
②③
③④
化学是研究物质组成、结构、性质及其变化规律的基础自然科学,请回答:
(1)从组成角度看:氯化钠是由 组成.
(2)从微粒角度看:氯化钠是由 构成(用微粒符号表示).
(3)从制备角度看:将海水进行 可得到粗盐.除去粗盐中含有的SO42﹣、Ca2+、Mg2+等杂质,常加入过量的①Na2CO3溶液、②BaCI2溶液、③NaOH溶液,三种试剂的加入顺序为 (填序号).碳酸钠和盐酸反应液能生成氯化钠,工业上不用此反应制备氯化钠的原因是 .
(4)从变化角度看:将氯化钠和水在通电条件下反应能生成一种碱、氢气和氯气(CI2),该反应的化学方程式为 .高中化学反应分为两类,一类是有元素的化合价升降的化学反应是氧化还原反应,另一类是反应前后元素化合价都没有改变的是非氧化还原反应,据此判断上述反应的类型为 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com