
题目列表(包括答案和解析)


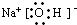
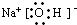


| 元素 | 有关信息 |
| A | 元素主要化合价为-2,原子半径为0.074nm |
| B | 所在主族序数与所在周期序数之差为4,同周期主族元素中原子半径最小 |
| C | 原子半径为0.102nm,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应水化物,能按1:1电离出电子数相等(10个电子)的阴阳离子 |
| E | 原子半径为0.075nm,最高价氧化物对应水化物与其氢化物组成一种盐X |
| 1 |
| 2 |
| 3 |
| 2 |
| ||
| ||


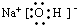
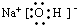
(13分)有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物;CB可与EA2反应生成C2A与气态物质EB4;E的M层电子数是K层电子数的2倍。
(1)写出这五种元素的名称:A ,B ,C ,D ,E 。
(2)画出E的原子结构示意图 ;
(3)写出电子式D2A2 ;EB4 。
(4)写出D单质与CuSO4溶液总反应的离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com