
题目列表(包括答案和解析)
(共17分) (1)下图是用KMnO4 与浓盐酸反应制取适量氯气的简易装置。
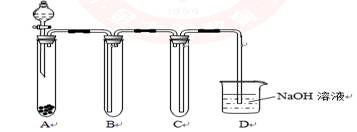
装置B、C、D的作用分别是:
B____________________C_________________ D
(2)在实验室欲制取适量NO气体。
①下图中最适合完成该实验的简易装置是_________(填序号);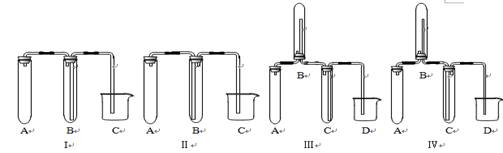
②根据所选的装置完成下表(不需要的可不填):
|
|
应加入的物质 |
所起的作用 |
|
A |
|
|
|
B |
|
|
|
C |
|
|
|
D |
|
|
③简单描述应观察到的实验现象:A中_______, , 。B中 。
(本题共8分)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_________________,
K值大小与温度的关系是:温度升高,K值______________
(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)  CO2(g)十H2 (g)十Q(Q>0)
CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)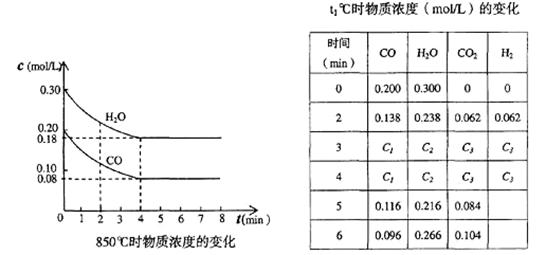
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min问,平衡向逆方向移动,可能的原因是________(单选),表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
(本题共8分)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_________________,
K值大小与温度的关系是:温度升高,K值______________
(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)  CO2(g)十H2 (g)十Q(Q>0)
CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)

(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min问,平衡向逆方向移动,可能的原因是________(单选),表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
(共16分)
(1)现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①该反应的逆反应为______反应(填“吸热”或“放热”),且m+n______ p (填“>”、“=”或“<”)。
②减压使容器体积增大时,A的质量分数________。(填“增大”、“减小”或“不变”,下同)
③若容积不变加入B,则A的转化率__________,B的转化率________。
④若升高温度,则平衡时B、C的浓度之比  将________。
将________。
⑤若加入催化剂,平衡时气体混合物的总物质的量________________________________
(2)在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:

在第5 min末将容器的体积缩小一半后,若在第8 min末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在图中画出第5 min末到平衡时NH3浓度的变化曲线。
漂白粉在生活、工业生产中用途广泛,漂白粉除了具有漂白作用外,还能杀菌消毒。2003年抗“非典”期间,各商场漂白粉及其他漂白产品曾一度脱销。
(1)1998年,我国长江流域和松花江流域都发生了百年不遇的特大洪水。灾区人们的饮用水,必须用漂白粉等药品消毒后才能饮用,以防传染病发生,但瓶装漂白粉久置空气中会失效。试用化学方程式表示漂白粉在空气中易失效的原因:① ;② 。
(2)已知浓盐酸和次氯酸钙能发生如下反应:
Ca(ClO)2+4HCl(浓)![]() CaCl2+2Cl2↑+2H2O
CaCl2+2Cl2↑+2H2O
用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是()
①CO2 ②HCl ③H2O ④O2
A.①②③ B.②③④ C.②③ D.①④
(3)用Cl2和石灰乳制作漂白粉的目的是()
A.转变为较HClO稳定且易储运的物质
B.转变为更易溶于水的物质
C.提高氯气的利用率
D.增强漂白能力
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com