
题目列表(包括答案和解析)
 二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.


| 实验步骤 | 实验现象 | 实验结论 |
| ①______ | ______ | 溶液X中含有钠离子 |
| ②______ | ______ | 溶液X中含有氯离子 |
(11分)氧化还原滴定法是科研和生产中测定溶液中物质浓度的常用方法。
⑴莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银滴定待测液,进而测定溶液中Cl-的浓度 [Ksp(AgCl) =1.56×10-10,Ksp(Ag2CrO4)=1.10×10-12,Ag2CrO4为砖红色]
①滴定终点的现象是_________________;
②硝酸银标准液应装在 式滴定管中滴定。
③已知该滴定适宜的酸度范围是pH 6.5~10.5,但当溶液中有铵盐存在,c(NH4+)<0.05mol/L时,应将溶液的pH控制在6.5~7.2。下列有关说法你认为合理的有__________。
a.若溶液pH<6.5,则Cr2O72—+H2O 2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
b.若溶液中有铵盐存在时,当pH>7.2,则有可能因为生成[Ag(NH3)2]+,影响实验结果
c.滴定时应剧烈摇动,以使被AgCl沉淀吸附的Cl- 及时释放出来,防止滴定终点提前
⑵氧化还原滴定是水环境监测常用的方法,可用于测定废水中的化学耗氧量(单位:mg/L——每升水样中还原性物质被氧化需O2的质量)。某废水样100.00mL,用硫酸酸化后,加入0.01667mol/L的K2Cr2O7溶液25.00mL,使水样中的还原性物质在一定条件下完全被氧化。然后用0.1000mol/L的FeSO4标准溶液滴定剩余的Cr2O72-,实验数据记录如下:
 实验数据 实验数据实验序号 | FeSO4溶液体积读数/mL | |
| 滴定前 | 滴定后 | |
| 第一次 | 0.10 | 16.20 |
| 第二次 | 0.30 | 15.31 |
| 第三次 | 0.20 | 15.19 |
有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E﹤A, R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素, Z原子核外电子数为24。
请回答下列问题:
(1)基态Z原子的核外电子排布式是 。AE2+与二氧化碳分子互为等电子体,AE2+的电子式是____。AX3 分子的VSEPR模型是 。
(2)某化合物由E、Y两种元素组成,其晶胞如图,该化合物的化学式为______。
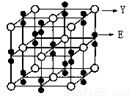
(3)在化合物Y2ZE4的水溶液入适量硫酸,能观察到的现象是 。
(4)A的简单氢化物极易溶于E的简单氢化物,其原因是 。
(5)A的最高价氧化物对应水化物的稀溶液与R的单质反应时,A被还原到最低价,该反应的化学方程式是 。
氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,仅铁架台和夹持仪器已略去。
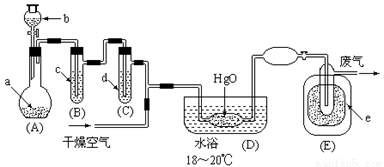
部分物质的有关物理数据如下:
|
化学式 |
熔点(单位:℃) |
沸点(单位:℃) |
|
N2 |
-209.86 |
-195.8 |
|
O2 |
-218.4 |
-183 |
|
CO2 |
-57 |
/ |
|
NH3 |
-77.3 |
-33.35 |
|
Cl2 |
-101 |
-34.6 |
试回答:
(1)A中深色固体与无色液体制备气体的离子方程式: 。
(2)B中盛有液体c是饱和 ,C中的液体d是浓硫酸。?
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是
(在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的 。
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无 管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com