
题目列表(包括答案和解析)
“化学是人类进步的关键”。下列说法不正确的是 ( )
| A.PM2.5是指空气中直径≤2.5 μm的固体颗粒或液滴的总称 |
| B.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间 |
| C.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素 |
D.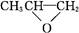 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物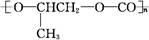 ,该反应符合绿色化学的原则 ,该反应符合绿色化学的原则 |
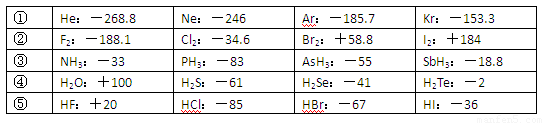
(10分)已知一些单质、化合物的沸点(1.01×105Pa,单位:℃)如下表所示: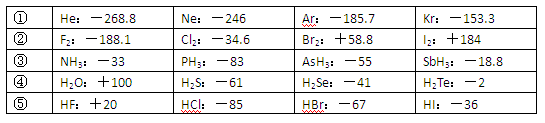
结合上表有关信息回答下列问题:
(1)判断下列说法不正确的是
| A.同周期元素的氢化物,原子序数越大,沸点越高 |
| B.上表中H2O、HF中由于含有氢键,故其分子特别稳定 |
| C.上表中,多数物质的沸点均与相对分子质量存在一定的关系 |
| D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高 |
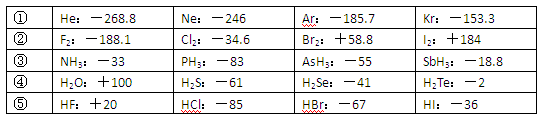
(10分)已知一些单质、化合物的沸点(1.01×105Pa,单位:℃)如下表所示:
结合上表有关信息回答下列问题:
(1)判断下列说法不正确的是
A.同周期元素的氢化物,原子序数越大,沸点越高
B.上表中H2O、HF中由于含有氢键,故其分子特别稳定
C.上表中,多数物质的沸点均与相对分子质量存在一定的关系
D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高
E.氢化物的稳定性越高,其沸点越高
(2)写出②系列中物质主要化学性质的递变规律(任写一种): ;能说明该递变规律的化学事实是 (任写一例,用离子方程式表示)。
(3)除极少数情况,同一系列中物质的沸点与相对分子质量之间存在一定的关系,该关系是 。
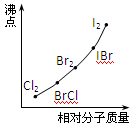
(4)部分XX’型卤素互化物(X、X’表示不同的卤原子)和卤素单质的沸点也与其相对分子质量存在着如右图所示的关系。试推测ICl的沸点所处的最小范围 (填“物质的化学式”)。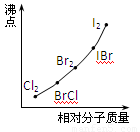
| A.同周期元素的氢化物,原子序数越大,沸点越高 |
| B.上表中H2O、HF中由于含有氢键,故其分子特别稳定 |
| C.上表中,多数物质的沸点均与相对分子质量存在一定的关系 |
| D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高 |

填空题
(1)下列说法中正确的是
①门捷列夫绘制出了第一张我们现在常用的元素周期表。②天然存在的同位素,相互间保持一定的比率。③元素的性质随着原子量的递增而呈周期性变化的规律叫做元素周期律。④燃料电池与干电池的主要差别在于反应物不同。⑤同系物之间分子量相差14。⑥由于存在化学反应的限度,所以一个化学反应在实际进行时不一定按照化学方程式的计量关系进行。⑦各种物质都储存有化学能。⑧甲烷和氯水在光照条件下发生取代反应,产物为混合物。
(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片
的质量减少了3.25克,铜表面析出了氢气 L(标准状况下),导线中通过 mol电子。
(3)在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则: 前2 min与后4 min相比,反应速率较快的是 ,其原因是
(4)已知下列原电池的总反应式:Cu+2FeCl3==CuCl2+2FeCl2,请写出电极反应方程式:
正极反应方程式为:
负极反应方程式为:
(5)已知断开1 molH-H键、1mol Br-Br键、1mol H-Br键分别需要吸收的能量为436kJ、193kJ、366kJ.。 计算H2和Br2反应生成1mol HBr需_______(填“吸收”或“放出”)能量_______kJ。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com