
题目列表(包括答案和解析)
某化学兴趣小组的同学想要绘制硝酸钾、食盐、氢氧化钙的溶解度曲线。用实验方法测定得到这三种物质在不同温度下在水中的溶解度数值,并记录如下:(图:硝酸钾、氯化钠、氢氧化钙在不同温度时的溶解度)
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 |
| 硝酸钾(克) | 13.3 | 31.6 | 37.7 | 48.8 | 63.9 | 92.5 |
| 氯化钠(克) | 35.7 | 35.8 | 36.0 | 36.3 | 36.5 | 36.8 |
| 氢氧化钙(克) | 0.19 | 0.18 | 0.17 | 0.16 | 0.14 | 0.12 |
(1)从表格或图像上分析:分离氯化钠和硝酸钾应采用的方法是 ;用此方法时,配制氯化钠和硝酸钾混合溶液的最佳温度为 ;分离时的最佳温度为 (从表格中选择数据填写)。在降温过程中,大量析出的物质是 ,为了提高晶体的纯度,应将过滤出的晶体用 (选填“热”或“冷”)水进一步洗涤干净。
(2)要把氢氧化钙的不饱和溶液转变成饱和溶液,可采取的方法有 、 和 。
 (2005?海门市)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.
(2005?海门市)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
| 溶液温度变化(△t)/℃ | 5.2 | 9.6 | 13.0 | 16.0 | 18.2 |
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
| 溶液温度变化(△t)/℃ | 5.2 | 9.6 | 13.0 | 16.0 | 18.2 |
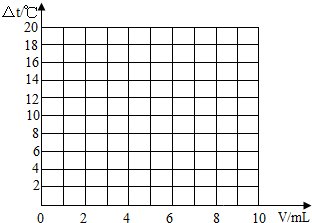
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
| 溶液温度变化(△t)/℃ | 5.2 | 9.6 | 13.0 | 16.0 | 18.2 |
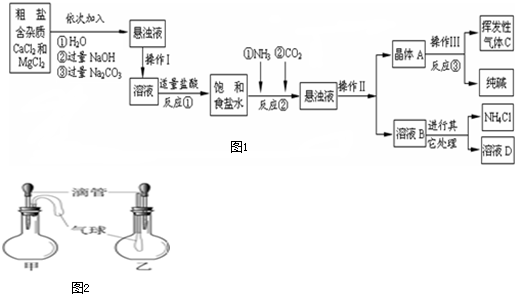
| ||
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com