实验室常用下列装置制取有关气体.
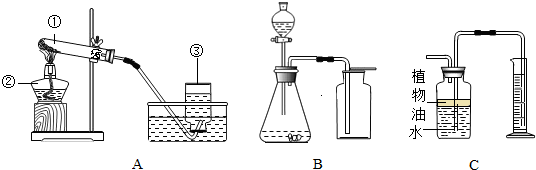
(1)用A装置来KMnO
4固体制取O
2,该发生装置还可以做我们学过的铜绿分解实验,写出这个反应的化学方程式:
(2)C装置可用来测量生成的CO
2气体的体积,其中在水面上放一层植物油的目的是
防止二氧化碳和水反应
防止二氧化碳和水反应
,植物油上方原有的空气对实验的结果
没有
没有
(填“有”或“没有”)明显影响.
(3)利用B\C组合装置测得反应生成气体体积偏大的最主要原因是:
利用该装置测得气体体积,实际包括反应生成的气体,还有滴入锥形瓶内的液体的体积,所以,所测得结果偏大
利用该装置测得气体体积,实际包括反应生成的气体,还有滴入锥形瓶内的液体的体积,所以,所测得结果偏大
.
(4)实验室里还可采用B图装置,通过用MnO
2作催化剂分解过氧化氢(H
20
2)的方法制取氧气.写出该反应的化学方程式:
(5)某研究小组对用H
2O
2分解生成H
2O和O
2的实验条件进行探究.他们进行以下实验:
①往盛有5mL5%H
2O
2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5mLω%H
2O
2溶液的试管中,加入a克MnO
2,伸入带火星的木条,木条复燃.
③往盛有5mLω%H
2O
2溶液的试管中,加入a克Fe
2O
3,伸入带火星的木条,木条复燃.
④经检验,②,③中反应后试管中仍分别含有a克MnO
2和a克Fe
2O
3.
问题:(1)MnO
2和Fe
2O
3是上述反应中的
催化
催化
剂.
(2)实验②,③中的H
2O
2的浓度(ω%)以
5%
5%
为宜.
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:用足量等体积H
2O
2溶液制取相同体积O
2所需的时间
浓度 时间(min)
条件 |
30%H2O2溶液 |
15%H2O2溶液 |
5%H2O2溶液 |
| a克MnO2 |
0.2 |
0.8 |
2.0 |
| a克Fe2O3 |
7.0 |
9.0 |
16.0 |
问题:(3)从上表中能得出哪些结论?
相同条件下,MnO2的催化效果比Fe2O3好
相同条件下,MnO2的催化效果比Fe2O3好
、
在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快.
在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快.
(至少写两点)
(6)[提出问题]小松同学用“双氧水”(过氧化氢溶液)清洗伤口时,不小心将过氧化氢溶液滴到水泥板上,发现有大量气泡产生.小松联想到自己曾经用二氧化锰做过氧化氢分解的催化剂,他想,水泥块能否也可作过氧化氢分解的催化剂呢?于是他到附近建筑工地取回一些小水泥块,并用蒸馏水浸泡,冲洗、干燥,并进行以下探究.
[猜想]水泥块能作过氧化氢分解的催化剂.
[实验验证]
|
实验步骤 |
实验现象 |
实验结论 |
| 实验一 |
往盛有过氧化氢溶液的试管中,伸入带火星的木条 往盛有过氧化氢溶液的试管中,伸入带火星的木条 |
木条不复燃 |
常温下过氧化氢溶液不分解 |
| 实验二 |
在装有过氧化氢溶液的试管中加入水泥块,然后将带火星的木条伸入试管中 |
木条复燃 |
过氧化氢溶液在水泥块的作用下能够分解产生氧气 过氧化氢溶液在水泥块的作用下能够分解产生氧气 |
[结论]水泥块能加快过氧化氢的分解速率,故水泥起能作过氧化氢的催化剂.
[讨论与反思]小芳认为:仅凭上述两个实验还不能证明水泥块为过氧化氢分解的催化剂,她觉得需要增加一个探究实验:探究
水泥块的质量在反应前后是否改变
水泥块的质量在反应前后是否改变
.
[实验步骤]①准确称量水泥块的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,
干燥
干燥
,
准确称量水泥块的质量
准确称量水泥块的质量
④对比反应前后水泥块的质量.
[分析]如果水泥块反应前后质量不变,则说明水泥块可以作为过氧化氢分解的催化剂.但小华认为,要证明小松的猜想,小芳的补充实验还是不足够,还需要再补充一个探究实验:探究
水泥块的化学性质是否改变
水泥块的化学性质是否改变
.

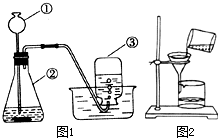 如图1所示,为某班同学在实验室用过氧化氢溶液和二氧化锰制取氧气的实验装置.
如图1所示,为某班同学在实验室用过氧化氢溶液和二氧化锰制取氧气的实验装置.