某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.
I、实验方案
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,测得的pH逐渐变小直到pH小于7,则证明NaOH溶液与稀盐酸发生了化学反应.
(1)反应后,所得溶液显
酸
酸
性(填“酸”、“碱”或“中”)
(2)用pH试纸测定NaOH溶液pH时,正确的操作是:
用干燥的玻璃棒蘸一滴NaOH溶液滴在干净的白瓷板或玻璃片上,再把试纸显示的颜色与标准比色卡比较,即可得出溶液的pH
用干燥的玻璃棒蘸一滴NaOH溶液滴在干净的白瓷板或玻璃片上,再把试纸显示的颜色与标准比色卡比较,即可得出溶液的pH
.
(3)简述强调“测得的pH小于7”的理由:
排除因稀释而使溶液pH减小的因素
排除因稀释而使溶液pH减小的因素
.
方案二:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生.如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应.
该组同学将不同浓度的盐酸和NaOH溶液各10克混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表).
| 编号 |
盐酸 |
NaOH溶液 |
△t/℃ |
| 1 |
3.65% |
2.00% |
3.5 |
| 2 |
3.65% |
4.00% |
x |
| 3 |
7.30% |
8.00% |
14 |
(4)表中x=
7
7
.
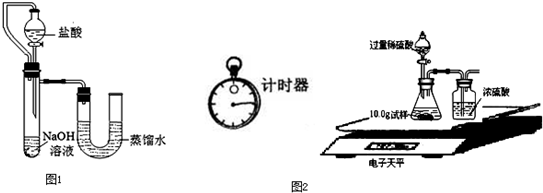
(5)某同学在没使用温度计的情况下,通过图1所示装置完成了实验.则该同学根据实验现象:
U形管中左边液面下降
U形管中左边液面下降
,判断NaOH溶液与稀盐酸发生了中和反应.
II、实验中的意外情况
在实验过程中,他们发现盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:①可能是NaOH;②可能是Na
2CO
3; ③可能是NaOH和Na
2CO
3.
(6)小明同学取白色粉末少许,溶于水后,先向溶液中加入足量的
CaCl2或BaCl2
CaCl2或BaCl2
溶液,看到白色沉淀产生,然后向上层清液中加入酚酞试液,看到溶液呈红色,验证了猜想③是正确的.
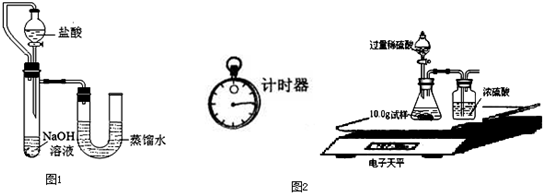
(7)为了进一步研究,三位同学取了10.0g上述样品,利用电子天平共同做了图所示的实验.
实验数据记录如下:
| 称 量 项 目 |
称 量 时 间 |
质量(g) |
| 试样 |
|
10.00 |
| 装置+稀硫酸质量 |
|
241.20 |
| 装置+稀硫酸质量+试样 |
反应开始后15秒 |
249.20 |
| 装置+稀硫酸质量+试样 |
反应开始后35秒 |
249.00 |
| 装置+稀硫酸质量+试样 |
反应开始后55秒 |
249.00 |
试通过分析表中数据计算上述样品中各成份的质量分数分别是多少?(写出计算过程).
(8)有同学提出按上述实验所测得试样中Na
2CO
3质量分数会偏小,该同学的理由是(实验操作均正确):
CO2的密度比空气大,残留在装置中,造成最终测得的质量偏大,测得生成的CO2质量偏小,故Na2CO3的质量分数偏小
CO2的密度比空气大,残留在装置中,造成最终测得的质量偏大,测得生成的CO2质量偏小,故Na2CO3的质量分数偏小
.