
题目列表(包括答案和解析)
| 实验方法 | 可能观察到的现象和结论 |
| 实验内容 | 实验现象 | 解释与结论 |
| 取反应后少量溶液于试管中,加入 固体化台物______. | ______ | 盐酸过量 |
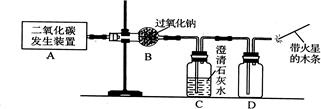 14、过氧化钠(化学式为Na2O2)可用在呼吸面具中作为氧气来源.Na2O2能跟CO2反应生成O2和另一种固体化合物 ( 用X表示 );也能跟H2O反应生成O2,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑.以下是某兴趣小组进行的探究活动.
14、过氧化钠(化学式为Na2O2)可用在呼吸面具中作为氧气来源.Na2O2能跟CO2反应生成O2和另一种固体化合物 ( 用X表示 );也能跟H2O反应生成O2,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑.以下是某兴趣小组进行的探究活动.| 实验操作 | 现 象 | 有关反应的化学方程式 |
| 方案一:取少量固体样品于试 管中,向其中 滴加稀盐酸,将气体通入澄清石灰水 . |
有气泡产生 ,澄清石灰水变浑浊 |
Na2CO3+2HCl=2NaCl+H2O+CO2↑ C02+Ca(OH)2=CaC03↓+H2O |
| 方案二:取少量固体,加水配 成溶液,滴加适量 氯化钙或氯化钡等 溶液 |
有白色沉淀产生 | Na2C03+CaCl2=CaC03↓+2NaCl 或Na2C03+BaCl2=BaC03↓+2NaCl等 |
| 实验 | 操作 | 现象 |
| 1 | 取少量固体放入试管中,滴加足量的稀盐酸 | 产生大量气泡 |
| 2 | 取少量固体放入试管中,加足量水,再滴加无色酚酞溶液 | 无气泡出现,溶液变红 |
| 3 | 取少量固体放入试管中,加足量水,再滴加澄清石灰水 | ______ |
| 实验操作 | 实验现象与结论 |
| 实验 | 操作 | 现象 |
| 1 | 取少量固体放入试管中,滴加足量的稀盐酸 | 产生大量气泡 |
| 2 | 取少量固体放入试管中,加足量水,再滴加无色酚酞溶液 | 无气泡出现,溶液变红 |
| 3 | 取少量固体放入试管中,加足量水,再滴加澄清石灰水 |
| 实验操作 | 实验现象与结论 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com