
题目列表(包括答案和解析)
 26、已知:Na2CO3+2HCl=2NaCl+H2O+CO2↑,某同学按右图装置对质量守恒定律进行实验探究,开始天平平衡,将试管中盐酸倒入烧杯中反应后观察天平不平衡,你认为该反应是否遵守质量守恒定律(填“遵守”或“不遵守”)
26、已知:Na2CO3+2HCl=2NaCl+H2O+CO2↑,某同学按右图装置对质量守恒定律进行实验探究,开始天平平衡,将试管中盐酸倒入烧杯中反应后观察天平不平衡,你认为该反应是否遵守质量守恒定律(填“遵守”或“不遵守”)答案:取少量溶液分别倒入3支试管中,然后分别滴加数滴Na2CO3溶液,有气泡产生的是盐酸;有白色沉淀生成的是石灰水;无现象的是氢氧化钠。
有关化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
 (2011?宁德质检)Ⅰ.氢氧化钠固体中可能混有碳酸钠,甲、乙、丙三位同学分别取样溶于水进行检验.
(2011?宁德质检)Ⅰ.氢氧化钠固体中可能混有碳酸钠,甲、乙、丙三位同学分别取样溶于水进行检验.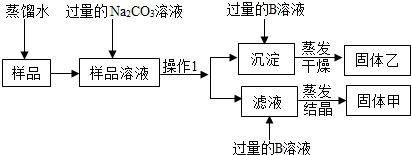
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com