
题目列表(包括答案和解析)
(14分)主族元素A、B、C、D的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在高温下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能激烈反应生成A的单质。所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。回答下列问题:
⑴写出元素符号A , D 。
写出B阴离子结构示意图 ;
写出C元素在周期表中的位置第 周期 族;
⑵写出C在足量B中充分反应后生成物的电子式 ,结构式 。
⑶写出B、D在加热条件下形成化合物的电子式 ,
判断其中的化学键的类型 。
用电子式表示B、D在不加热条件下形成化合物的形成过程 。
⑷写出一种有A、B、C、D组成的化合物的化学式 。
(20分)
19-I(6分)下列描述中正确的是
A、CS2为V形的极性分子
B、Cl0— 3 的空间构型为平面三角形
C、SF6中有6对完全相同的成键电子对
D、SiF4和SO2— 3 的中心原子均为sp3杂化
19-Ⅱ(14分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为______________________________;
(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)Ni0晶胞中Ni和O的配位数分别为_______________、_______________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是![]() 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
②该结构中,氧氢之间除共价键外还可存在_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
(14分)长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂被氧化的程度,设计了下图实验,请回答下面的问题: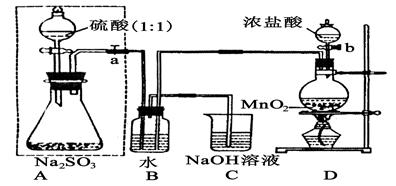
(1)D装置中反应的化学方程式为 。
B装置中反应的离子方程为 。
(2)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应、过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为: 。
(3)为保证实验测定的准确性,A中的硫酸什么时候滴加
C装置中的作用是 _________________。
(4)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法,测定试样中无水亚硫酸钠被氧化的程度,你使用试剂的顺序为: 。(填试剂编号)
实验室欲配制100 mL0.92 mol•L-1的H2SO4溶液(本小题每空2分,共14分)
(1)需要用到的仪器,除了烧杯、空试剂瓶、玻璃棒、量筒、还必须有 ;
(2)若提供的是18.4 mol•L-1的浓H2SO4,求所需量取的浓H2SO4的体积为 mL;
(3)对配制过程中的下列说法,正确的是 。(填序号,多选、少选均不得分)
A.量筒量取浓硫酸后要冲洗并将冲洗液一起倒入小烧杯
B.量好体积的浓硫酸应先倒入小烧杯中然后再加水稀释
C.稀释好的稀硫酸要立即转移入容量瓶
D.若定容后摇匀液面又下降了。则必须再补加水至刻度线。
(4)配制稀硫酸的容量瓶必须洗涤,若用含有蒸馏水的容量瓶未干燥就配制稀硫酸,
则所配稀硫酸浓度将 (偏高、偏低、不变);若用刚配制过NaOH
溶液的容量瓶未洗涤就配制稀硫酸,则所配制的稀硫酸溶液的浓度将
(偏高、偏低、不变);若用刚配制过HCl溶液的容量瓶未洗涤就配制稀硫酸,则
所配制稀硫酸浓度将 (偏高、偏低、不变),
氢离子浓度将 (偏高、偏低、不变)。
(14分)工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c..浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含少量的H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com