酸雨是pH小于5.6的降水.我国大部分地区所降酸雨主要是由居民和工厂燃烧含硫的煤以及某些化工厂生产过程中排放的二氧化硫气体,经过一系列化学反应而形成的.
(1)如果硫粉在氧气中燃烧,观察到的现象是
剧烈燃烧,放出热量,产生明亮的蓝紫色火焰,产生一种无色有刺激性气味的气体
剧烈燃烧,放出热量,产生明亮的蓝紫色火焰,产生一种无色有刺激性气味的气体
,该反应的化学方程式为
.
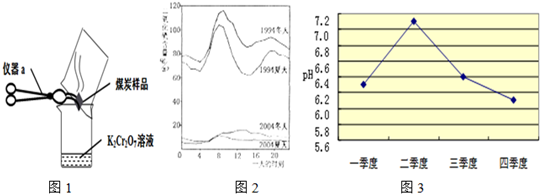
(2)几位同学为了探究木炭中是否含有少量硫元素,他们设计了如图1所示实验进行测定.请写出图中仪器a的名称:
坩埚钳
坩埚钳
.他们查阅资料后得知:“二氧化硫能使K
2Cr
2O
7溶液褪色(由橙红色变成绿色),反应方程式为:“3SO
2+K
2Cr
2O
7+H
2SO
4═K
2SO
4+

+H
2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
Cr2(SO4)3
Cr2(SO4)3
.反应前K
2Cr
2O
7中Cr元素化合价为
+6
+6
价.
(3)如图2是1994年和2004年某城市的一天各个时刻测到的空气中二氧化硫的含量.下列说法不正确的是
D
D
A.曲线显示冬天大气中的二氧化硫含量比夏天高
B.曲线显示了1994年一天中大约8点左右二氧化硫的含量较高
C.二氧化硫的含量在10年间降低的原因可能是加强了燃料的脱硫和控制了二氧化硫的排放
D.二氧化硫污染的主要来源是汽车排放的尾气,控制污染的方法是禁止使用汽车
(4)在研究酸雨危害的过程中,测定该地区雨水的pH的实验操作
用玻璃棒蘸取雨水,点在试纸上,与标准比色卡对照,读取数值
用玻璃棒蘸取雨水,点在试纸上,与标准比色卡对照,读取数值
.
某化学兴趣小组取刚降到地面的雨水,每隔一定时间用较精密的pH计测定其pH,数据如下:
| 测定时间/分钟 |
0 |
1 |
2 |
3 |
| pH |
4.73 |
4.62 |
4.56 |
4.55 |
由此可知该雨水的酸性越来越
强
强
(填“强”或“弱”),最终趋于稳定.可能的原因是雨水中的H
2SO
3被氧气氧化为H
2SO
4,化学方程式为
2H2SO3+O2=2H2SO4
2H2SO3+O2=2H2SO4
.
(5)酸雨造成的危害很多.某兴趣小组调查发现某市的石刻的表面有不同程度的腐蚀.且近20年的腐蚀速度大大超过以往,其中最主要原因之一就是酸雨.为了减缓石刻腐蚀,请你提一条建议:
使用清洁能源
使用清洁能源
.酸雨会使河流、湖泊酸化.如图3是某市去年某河流一年中不同时期河水的平均pH变化的折线图.则去年河水酸性最强的季度是第
四
四
季度.该季度雨水酸性最强的原因可能是:(答两条)
冬季取暖,需要燃烧大量化石燃料,加大了对河水的污染
冬季取暖,需要燃烧大量化石燃料,加大了对河水的污染
;
冬季降水量减少,河水中酸的浓度增大
冬季降水量减少,河水中酸的浓度增大
.
酸雨还会使土壤酸化.为了中和酸性土壤,可以使用熟石灰粉末,若该酸雨的成分是硫酸,请写出该中和反应的化学方程式
H2SO4+Ca(OH)2=CaSO4+2H2O
H2SO4+Ca(OH)2=CaSO4+2H2O
.
(6)某校化学兴趣小组在学完碱的化学性质后,想到用NaOH溶液吸收SO
2,反应化学方程式如下:2NaOH+SO
2═Na
2SO
3+H
2O 用NaOH溶液吸收1000L已除去CO
2的空气样品,溶液质量增重了0.64g.已知此时空气的密度约为1.3g/L,求:
①被吸收的SO
2的质量
0.8
0.8
g.
②发生反应的NaOH的质量.(相对原子质量:Na-23 S-32 O-16)
③空气中SO
2的质量分数(计算结果精确到0.01%).


 +H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
+H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式: