碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
查阅资料:获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解.
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
(4)澄清石灰水中的Ca(OH)
2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)
2.
方案设计和实施:根据资料和已学知识,该小组同学设计如下两种方案进行测定.
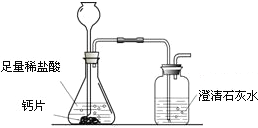
方案1:根据下图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为
.
(2)长颈漏斗下部插入液面下的目的是
.
(3)加入药品前,检验该装置气密性的方法是
.
(4)记录数据如下:
| 钙片质量 |
空洗气瓶质量 |
澄清石灰水的质量 |
反应后洗气瓶及瓶内物质总质量 |
| 25g |
100g |
200g |
300.4g |
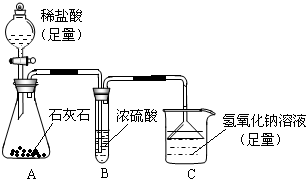
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量.记录数据如下(空烧杯质量为100g,加入钙片质量为25g):
| 加入稀盐酸的质量 |
100g |
200g |
300g |
400g |
| 充分反应后烧杯及杯内物质总质量 |
222.8g |
320.6g |
418.4g |
518.4g |
分析和评价:
(1)方案1和方案2中合理的是
,原因是
.
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是
.
(3)要使用查阅资料(3)中介绍的方法,还需要学习的是
.
结论:经过计算,该钙片中碳酸钙的质量分数是
.


 (4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.