
题目列表(包括答案和解析)
(7分)用中和滴定法测定某烧碱样品的纯度。(锥形瓶中装待测液)
配制待测液:将2.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制200mL溶液。
(1) 滴定:盛装0.20mol/L盐酸标准液应该用酸式滴定管;滴定时,先向盛待测液的锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视__________________________________。
滴定终点的现象是:________________ ___________________
(2) 有关数据记录如下:
|
滴定序号 |
待测液体积(ml) |
所消耗盐酸标准液的体积(ml) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.50 |
20.55 |
|
2 |
20.00 |
6.00 |
25.95 |
纯度计算:烧碱样品的纯度为________________。
(3) 对几种假定情况的讨论:(填无影响、偏高、偏低)(说明:测定的结果指烧碱样品的纯度)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果___________________
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,则会使测定结果__________
③滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果__________。
(7分)用中和滴定法测定某烧碱样品的纯度。(锥形瓶中装待测液)
配制待测液:将2.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制200mL溶液。
(1) 滴定:盛装0.20mol/L盐酸标准液应该用酸式滴定管;滴定时,先向盛待测液的锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视__________________________________。
滴定终点的现象是:___________________________________
(2) 有关数据记录如下:
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.55 |
| 2 | 20.00 | 6.00 | 25.95 |
纯度计算:烧碱样品的纯度为________________。
(3) 对几种假定情况的讨论:(填无影响、偏高、偏低)(说明:测定的结果指烧碱样品的纯度)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果___________________
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,则会使测定结果__________
③滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果__________。
【7分】请按要求填空。
下列实验操作或对实验事实的叙述正确的是_________。(填序号)
①用稀HNO3清洗做过银镜反应实验的试管;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③用碱式滴定管量取20.00 mL 0.100 0 mol·L-1 KMnO4溶液;
④用托盘天平称取10.50 g干燥的NaCl固体;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸。
(7分) DIS系统即数字化信息系统,它由传感器、数据采集器和计算机组成,某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。实验步骤如下:
(1) 用_________________(填仪器名称)量取10. 00mL的食用白醋,在烧杯中用水稀释后转移到100mL________(填仪器名称)中定容,然后将稀释后的溶液倒人试剂瓶中。
(2)量取20. 00 mL的上述溶液倒入烧杯中,连接好DIS 系统(如上图),向烧杯中滴加浓度为0.1000mol·L -1的氨水,计算机屏幕上显示出溶液导电能力随
氨水体积变化的曲线(见图)。
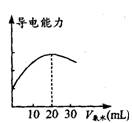
①用滴定管盛氨水前,滴定管要用__________润洗2~3遍
②氨水与醋酸反应的离子方程式是___________________。
③食用白醋中醋酸的物质的量浓度是__________________。
(10分)维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,人体缺乏这样的维生素能得坏血症,所以维生素C又称抗坏血酸。在新鲜的水果、蔬菜、乳制品中都富含维生素C,例如新鲜橙汁中维生素C的含量在500mg/L左右。十二中某研究性学习小组测定了某品牌软包装橙汁中维生素C的含量,下面是他们的实验分析报告。
(一)测定目的:测定×××牌软包装橙汁中维生素C的含量。
(二)测定原理:C6H8O6+I2 →C6H6O6+2H++2I―
(三)实验用品及试剂
(1)仪器和用品(自选,略)
(2)试剂:指示剂_________(填名称,1分),浓度为8.00×10-3mol·L-1的I2标准溶液、蒸馏水等。
(四)实验过程
(3)洗涤仪器,检查滴定管是否漏液,润洗相关仪器后,装好标准碘溶液待用。
(4)用________________(填仪器名称,1分)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
(5)用左手控制滴定管的____________(填部位,1分),右手摇动锥形瓶,眼睛注视___________(1分),直到滴定终点。滴定至终点时的现象是________________(2分)。
(五)数据记录与处理

(6)若经数据处理,则此橙汁中维生素C的含量是____________mg/L(2分)。
(六)问题讨论
(7)从分析数据看,此软包装橙汁是否是纯天然橙汁?_______(填“是”或“不是”或“可能是”,1分)。生产商最可能采取的做法是__________(填编号,1分):
A.加水稀释天然橙汁 B.将维生素C作为添加剂 C.橙汁已被浓缩
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com