
题目列表(包括答案和解析)
(8分)使一定量Zn与100 ml 18.5 mol/L浓H2SO4充分反应,Zn完全溶解,同时生成标准状况下气体33.6L。将反应后溶液稀释至1L,测得其c(H+) = 0.1mol/L。求:
(1)生成气体的成分为: ;
(2)Zn的质量为 g;
(3)开始生成H2时H2SO4的浓度为 mol/L。(假设溶液体积无变化)
(8分)稀HNO3和锌反应的化学方程式如下:
4Zn + 10 HNO3 = 4Zn(NO3)2 +N2O↑+5H2O
(1)请标明上述化学方程式中电子转移的方向和数目。
(2)该反应中还原剂是 ,还原产物是 ,每2 mol Zn参加反应,转移的电子 个。
(3)上述反应中,HNO3没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸与总硝酸的物质的量之比是 。
(8分)稀HNO3和锌反应的化学方程式如下:
4Zn + 10 HNO3= 4Zn(NO3)2 +N2O↑+5H2O
(1)请标明上述化学方程式中电子转移的方向和数目。
(2)该反应中还原剂是 ,还原产物是 ,每2 mol Zn参加反应,转移的电子 个。
(3)上述反应中,HNO3没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸与总硝酸的物质的量之比是 。
(8分)分类法是一种重要的学习方法。
(1)请按要求对下列物质进行分类
①铝粉②熔融的硝酸钾③氯气④硫酸钡固体⑤氯化氢气体⑥石灰水⑦无水乙醇⑧氧化钠固体⑨二氧化碳气体
其中能导电的是 ,属于电解质的是 (均填序号)。
(2)下列4组物质中均有一种物质的类别与其它三种不同,请分别填出其化学式。
甲.CaO、Na2O、CO2、CuO 乙.NaOH、Ca(OH)2、KHCO3、KOH
丙.C、Fe、Cu、Zn 丁.CO、H2、SO2、HCl
甲 ;乙 ;丙 ;丁 。
(8分)对下图中电极加以必要的连接并填空: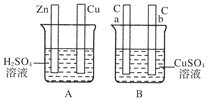
(1)在A图中,使铜片上冒气泡。请加以必要连接,则连接后的装置叫________。电极反应式:
锌板:_______________________________________________________________;
铜板:______________________________________________________________。
(2)在B图中,使a极析出铜,则b极析出________。加以必要的连接后,该装置叫________。电极反应式,a极:________;b极:________。经过一段时间后,停止反应并搅匀溶液,溶液的pH________(填“升高”、“降低”或“不变”)。
(3)将A、B图中Cu板与a极、Zn板与b极用导线连接,则连接后的A装置叫________,B装置叫________。Zn板为________极,a极为________极。A图发生的总反应的化学方程式为__________________,B图发生的总反应的离子方程式为
________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com