
题目列表(包括答案和解析)
右图所涉及的物质均为中学化学中的常见物质,其中C为黄绿色气体,A为金属单质,D在C中燃烧发出苍白色火焰,生成J,B是J的水溶液,H是红褐色沉淀。它们存在如图转化关系,反应中部分物质已略去。
(1)写出有关物质的化学式:
C______________,E_____________,F______________, H_____________。
(2)写出A+B→D+E的离子方程式
__________________________________________
(3)写出G→H的化学方程式____________________________________________________

右图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物。它们存在如图所示的转化关系,反应中生成的水及次要产物均已略去。

(1)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(2)若反应①是在加热条件下进行,则A是 ;若反应①是在常温条件下进行,则A是 。
(3)写出B与MnO2共热获得D的化学方程式 。
(4)写出B与F反应的离子方程式 。
右图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物。它们存在如图所示的转化关系,反应中生成的水及次要产物均已略去。
(1)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(2)若反应①是在加热条件下进行,则A是 ;若反应①是在常温条件下进行,则A是 。
(3)写出B与MnO2共热获得D的化学方程式 。
(4)写出B与F反应的离子方程式 。
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义。
请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜。该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g) △H=-768.2KJ·mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0KJ·mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的 △H= 。
 (2)硫酸生产中涉及反应:2SO
(2)硫酸生产中涉及反应:2SO![]() (g)+O
(g)+O![]() (g)
(g)![]() 2SO
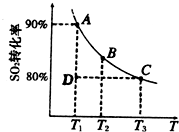
2SO![]() (g)。 ① 一定条件下,的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
(g)。 ① 一定条件下,的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
② 某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol·L-1,则0~10min内的平均反应速率v(SO2)= ,该温度下反应的平衡常数K= 。
③ 下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO![]() 的体积分数不再发生变化
的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
④ 以下操作将引起平衡向正反应方向移动并能提高SO![]() 转化率的是
转化率的是
A.向容器中通入少量O![]() B.向容器中通入少量SO
B.向容器中通入少量SO![]()
C.使用催化剂 D.升高温度 E.恒容通入少量氦气
⑤ 气体SO2是大气污染物,可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com