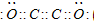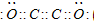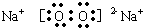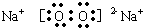现有A、B、C、D、E、F六种短周期元素.它们的原子序数依次增大,A元素的某核素的原子核内没有中子,A与C、B与F同主族,C、D、F同周期,C、D、F的最高价氧化物的水化屋之间可以两两相互反应,D、E原子的最外层电子数之和等于F原子的最外层电子数,D的单质参与的反应可以用来野外焊接钢轨,E为传统无机非金属材料的重要组成元素,请回答下列问题:
(1)F的元素名称
氯
氯
,D在元素周期表中的位置是
第三周期第IIA族
第三周期第IIA族
.
(2)A、B、C、D、E五种元素的原子半径由大到小的顺序为(填元素符号)
Na>Al>Si>F>H
Na>Al>Si>F>H
.
(3)写出D单质参与的焊接钢轨的主要反应的化学方程式
.分别写出D、E的氧化物与C的最高价氧化物的水花物反应的化学方程式
Al2O3+2NaOH═2NaAlO2+H2O
Al2O3+2NaOH═2NaAlO2+H2O
,
2NaOH+SiO2═Na2SiO3+H2O
2NaOH+SiO2═Na2SiO3+H2O
.
(4)A元素分别与B、E、F元素构成的三种二元化合物的热稳定性由强到弱的顺序是(用化学式表示)
HF>HCl>SiH4
HF>HCl>SiH4
.
(5)用电子式描述C与F构成的化合物形成过程
.
(6)试用事实说明B与F两种元素的非金属性强弱
在黑暗处氟气能和氢气发生反应且产生爆炸,光照条件下,氯气和氢气反应生成氯化氢
在黑暗处氟气能和氢气发生反应且产生爆炸,光照条件下,氯气和氢气反应生成氯化氢
.

 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.