
题目列表(包括答案和解析)
 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H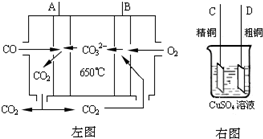
| 10 |
| 11 |
| ||
| 氢离子 |
| 石灰水 |
 转化为Cr2O72-.又知:常温时该反应的平衡常数K=1014.上述酸化后所得溶液的pH=______.
转化为Cr2O72-.又知:常温时该反应的平衡常数K=1014.上述酸化后所得溶液的pH=______. Cr3+
Cr3+ Cr(OH)3.用该方法处理10m3 CrO42-的物质的量浓度为1.0×10-3 mol?L-1的废水,至少需要绿矾______Kg(保留两位小数).
Cr(OH)3.用该方法处理10m3 CrO42-的物质的量浓度为1.0×10-3 mol?L-1的废水,至少需要绿矾______Kg(保留两位小数).
(13分)Ⅰ.一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+ 172.5 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO除SO2的热化学方程式 ▲ 。
(3)下图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式 ▲ 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 ▲ 极 (填:“C”或“D”)相连。
③当消耗2.24 L(标况下)CO时,粗铜电极理论上减少铜的质量 ▲ (填:“大于”、“等于” 或“小于”)6.4克。
Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 ▲ mol·L-1,然后再进行后续处理方能达到国家排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
一种混合动力车,可以分别用电动机、内燃机或者二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车和下坡时内燃机提供推动力,使电动机处于充电状态。目前内燃机以汽油为燃料,电动机一般使用镍氢电池(KOH作电解液)。
试分析回答下列问题:
(1)已知汽车在刹车和下坡时,镍氢电池两电极反应分别为:
甲电极:M+H2O+e-→MH+OH-(M为储氢合金,MH为吸附了氢原子的储氢合金)
乙电极:Ni(OH)2+OH--e—→NiOOH+H2O
则在这一过程中甲、乙两电极的名称分别是:甲: ;乙: 。
(2)当汽车上坡或加速时,镍氢电池两电极反应分别为:
甲电极: ;乙电极: ;
电极周围溶液的pH变化是(选填“增大”或“不变”或“减小",下同)甲 ;乙 。
(3)内燃机工作时因为部分汽油不完全燃烧会产生污染大气的CO,已知在常温常压下:
C8 H18(1)+25/2 O2(g)=8CO2(g)+9 H2O(g);△H=-5121.9kJ/mol
2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
H2 O(g)=H2O(1);△H=-44.0kJ/mol
写出汽油不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(4)为降低汽车尾气中的一氧化碳的浓度,可采取在汽车的排气管上增加一个补燃器,通过下列反应来实现转化:
2 CO(g)+O2(g)= 2CO2(g)
已知在温度为T的条件下,当补燃器中化学反应速率(正)=v(逆)时,各物质浓度存在下列恒定关系:
在温度为T的条件下,若某汽车排人补燃器的CO、CO2的浓度分别为1.0×10-5mol·L-1和1.01×10-4mol·L-1,要在该温度下使最终尾气中CO的浓度降为1.0×10-6mol·L-1,则补燃器中应不断补充O2,并使O2浓度保持在 mol·L-1。
(13分)Ⅰ.一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g) Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+ 172.5 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO除SO2的热化学方程式 ▲ 。
(3)下图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式 ▲ 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与▲ 极(填:“C”或“D”)相连。
③当消耗2.24 L(标况下)CO时,粗铜电极理论上减少铜的质量 ▲ (填:“大于”、“等于” 或“小于”)6.4克。
Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+ Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 ▲ mol·L-1,然后再进行后续处理方能达到国家排放标准。
②还原法:CrO42- Cr3+
Cr3+ Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com