
题目列表(包括答案和解析)
把18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫酸100 mL,实验操作如下,请把正确操作步骤(用1,2,3……表示)的序号填入括号内,并填写有关的空格:
( )将配好的稀硫酸倒入试剂瓶中,贴好标签;
( )盖好容量瓶塞,反复颠倒,摇匀;
( )用量筒量取 mL的18.0 mol·L-1的浓硫酸;
( )将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
( )用少量蒸馏水洗涤烧杯2-3次,并将洗涤液也全部转移到容量瓶中;
( )将已冷却至室温的硫酸溶液沿玻璃棒注入 mL的容量瓶中;
( )改用胶头滴管逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
( )继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处;
请回答:若在操作中没有把少量蒸馏水洗涤烧杯的洗涤液全部转移到容量瓶中,会使稀硫酸溶液的浓度 (填>,<或=)2.00 mol·L-1。若加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水到刻度线,会使稀硫酸溶液的浓度 (填>,<或=)2.00 mol·L-1 。
把18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫酸100 ml,实验操作如下,请把正确操作步骤(用1,2,3……表示)的序号填入括号内,并填写有关的空格:
( )将配好的稀硫酸倒入试剂瓶中,贴好标签;
( )盖好容量瓶塞,反复颠倒摇匀;
( )用量筒量取________ml的18.0 mol·L-1的浓硫酸;
( )将________沿烧杯内壁慢慢注入盛有少量________的烧杯中;
( )用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
( )将已冷却至室温的硫酸溶液沿玻璃棒注入________;
( )改用胶头滴管逐滴加蒸馏水,至________;
( )继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2 cm处;
请回答:
若在操作中没有把少量蒸馏水洗涤烧杯的洗涤液全部转移到容量瓶中,会使稀硫酸溶液的浓度________(填“大于”、“小于”或“等于”)2.00 mol·L-1.若加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水到刻度线,会使稀硫酸溶液的浓度________(填“大于”、“小于”或“等于”)2.00 mol·L-1.
甲学生急需3.0 mol·L-1稀硫酸做探究性实验,而此时实验室只有18.4 mol·L-1浓硫酸.请你为他配制100 mL 3.0 mol·L-1稀硫酸.
(1)建议配制过程如下:
①计算所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(从下列中选用A.10 mL;B.25 mL;C.50 mL;D.100 mL).
②稀释.具体操作过程是________.
③待上步得到的稀释液充分冷却后,借助玻璃棒引流,注入________.用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液也注入其中.轻轻摇动容量瓶,使溶液混合均匀.
④将蒸馏水注入容量瓶,待液面离容量瓶刻度线1-2 cm,改用________加水至液面与刻度线相切.盖好瓶塞,反复上下颠倒、摇匀.
⑤将配好的溶液转移到试剂瓶中,交甲同学使用.
(2)在配制溶液过程中,遇到下列情况时,实际浓度会怎样?(填偏高、偏低或不影响)
A.所用的浓硫酸长时间放置在密封不好的容器中________
B.容量瓶用蒸馏水洗涤后残留有少量的水________
C.所用过的烧杯、玻璃棒未洗涤________
D.定容时俯视刻度线________
(15分)(1)25℃时,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010。请回答下列问题:
①HA是________(填“强电解质”或“弱电解质”);
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
③若M溶液是由上述HA溶液V1 mL与pH = 12的NaOH溶液V2 mL混合充分反应而得,则下列说法中正确的是
A.若溶液M呈中性,则溶液M中c(H+) + c(OH-) = 2.0×10-7 mol·L-1
B.若V1 =V2 ,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2
(2)若已知在25℃,AgCl的Ksp = 1.8×10-10,现将足量AgCl分别放入:①100 mL 蒸馏水中;②100 mL 0.2mol·L-1 AgNO3溶液中;③100 mL 0.1mol·L-1 AlCl3溶液中;④100 mL 0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是 (用序号连接)
(3)若1mol SO2(g)氧化为1mol SO3(g)的ΔH =-99kJ·mol-1,单质硫的燃烧热为296kJ·mol-1,则由S(s)生成3 mol SO3(g)的ΔH =
(4)对于2NO2(g) N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。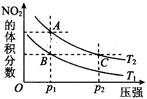
①.A、C两点的反应速率:A>C
②.A、C两点气体的颜色:A深、C浅
③.B、C两点的气体的平均分子质量:B<C
④.由状态B到状态A,可以用加热方法
(5)下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图: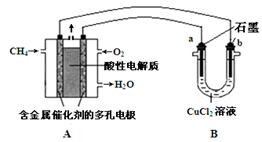
请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.2 mol电子通过时,阴极增重____g。
 N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com