
题目列表(包括答案和解析)
| 编号 | 信 息 |
| 1 | D为地壳中含量最高的元素组成的单质 |
| 2 | E为酸性氧化物,不溶于水,能与某种酸反应 |
| 3 | F不溶于水,F用于制备干燥剂以及催化剂的载体 |
| 4 | H为淡黄色固体化合物 |
| 5 | 电解饱和J溶液是工业生产中的重要反应 |
| 6 | C为离子化合物,阴、阳离子均含有金属元素 |
| 7 | K为酸雨的主要成分 |
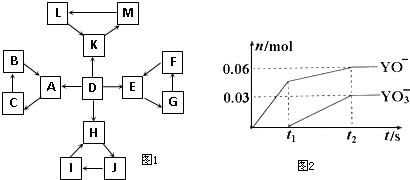
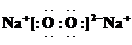
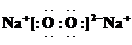
| ||
| ||
| 信 息 | |
| 1 | D为地壳中含量最高的元素组成的单质 |
| 2 | E为酸性氧化物,不溶于水,能与某种酸反应 |
| 3 | F不溶于水 |
| 4 | H为淡黄色固体化合物 |
| 5 | 电解饱和J溶液是工业重要反应 |
| 6 | C为离子化合物,阴、阳离子均含有金属元素. |
(7分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T在周期表中的位置 __________,第六周期与R同主族元素的原子序数为 ,该元素为 元素(填“金属”或“非金属”)
(2)元素的非金属性(原子得电子的能力):Q________T(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为______________________________________________。
(4)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的 R的含氧酸盐只有一种,则该含氧酸盐的化学式是____________。
【解析】根据元素在周期表中的位置可知T属于第三周期,T所处的周期序数与主族序数相等,所以T是Al,则Q是C,R是N,W是S。
(1)N是第ⅤA,所以第六周期、第ⅤA元素的原子序数是7+8+18+18+32=83,该元素是铅,属于金属元素。
(2)C是非金属,Al是金属,前者的非金属性强于后者。
(3)单质硫的化合价是0价,浓硫酸中硫的化合价是+6价,若二者反应的生成物只有2种,且一种是气体,因为生成物一定有水,则该气体只能是SO2。
(4)N的氧化物中相对分子质量最下的是NO。在反应中NO和O2的物质的量之比是4︰1,根据得失电子守恒可知NO的失去1个电子,化合价由+2价升高到+3价,因此含氧酸盐是NaNO2。
(7分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

(1)T在周期表中的位置 __________,第六周期与R同主族元素的原子序数为 ,该元素为 元素(填“金属”或“非金属”)
(2)元素的非金属性(原子得电子的能力):Q________T(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为______________________________________________。
(4)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的 R的含氧酸盐只有一种,则该含氧酸盐的化学式是____________。
【解析】根据元素在周期表中的位置可知T属于第三周期,T所处的周期序数与主族序数相等,所以T是Al,则Q是C,R是N,W是S。
(1)N是第ⅤA,所以第六周期、第ⅤA元素的原子序数是7+8+18+18+32=83,该元素是铅,属于金属元素。
(2)C是非金属,Al是金属,前者的非金属性强于后者。
(3)单质硫的化合价是0价,浓硫酸中硫的化合价是+6价,若二者反应的生成物只有2种,且一种是气体,因为生成物一定有水,则该气体只能是SO2。
(4)N的氧化物中相对分子质量最下的是NO。在反应中NO和O2的物质的量之比是4︰1,根据得失电子守恒可知NO的失去1个电子,化合价由+2价升高到+3价,因此含氧酸盐是NaNO2。
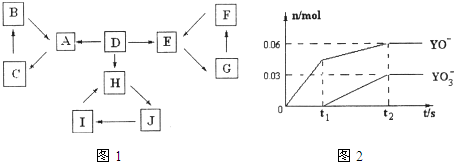
物质A、B、C、D、E、F、G、H、I、J有如图所示的转化关系。

图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素。其它信息见下表:
|
编号 |
信 息 |
|
1 |
D为地壳中含量最高的元素组成的单质 |
|
2 |
E为酸性气态氧化物 |
|
3 |
F的浓溶液常做干燥剂 |
|
4 |
H为淡黄色固体化合物 |
|
5 |
电解饱和J溶液是工业重要反应 |
|
6 |
C为离子化合物,阴、阳离子均含有金属元素 |
(1)写出G的化学式: ,指出H中化学键的类型: 。
(2)常温下测得一定浓度的C溶液的pH=10,用离子方程式表示其原因 。
(3)写出与H相对分子质量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的化学式 。
(4)写出C溶液中通入过量CO2的化学方程式: 。

(5)通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中三种含Y元素的离子,其中两种离子物质的量(n)与反应时间(t)的变化示意图如上图所示,写出该反应的离子方程式是 ,该苛性钾溶液中KOH的质量是 g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com