
题目列表(包括答案和解析)

(1)该实验应选择图中的a还是b装置?
___________________________________________________
(2)反应装置中的烧瓶应选择下列哪种规格最合适?
__________________________
A.50 mL B.100mL C.150mL D.250mL
(3)冷凝管中的冷凝水的流向应是_____________。
A.A进B出 B.B进A出 C.从A进或B进均可
(4)由NaBr浓H2SO4和乙醇共热制备C2H5Br反应的化学方程式为_________________
________________。可能发生的副反应为:_____________________________________。
(5)上述实验完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有_____________________________________________________________。
(6)从棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是__________________,必须使用的仪器是_______________________________。
(7)本实验的产率为60%,则可制取溴乙烷______________g。
(8)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏。为证明最终得到的产品一溴乙烷中含有溴元素,可采取的实验方法是_____________________________
__________________________________________________。
实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷,已知反应物的用量:0.3mol NaBr(s);0.25mol乙醇;36mL浓硫酸(溶质分数为98%,密度1.84g×mL-1);25mL水,其中乙醇的密度为0.80g×cm-3,回答下列问题。
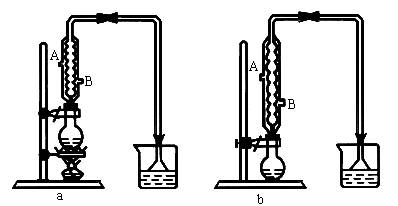
(1)该实验应选择图中的a还是b装置?
___________________________________________________
(2)反应装置中的烧瓶应选择下列哪种规格最合适?
__________________________
A.50 mL B.100mL C.150mL D.250mL
(3)冷凝管中的冷凝水的流向应是_____________。
A.A进B出 B.B进A出 C.从A进或B进均可
(4)由NaBr浓H2SO4和乙醇共热制备C2H5Br反应的化学方程式为_________________
________________。可能发生的副反应为:_____________________________________。
(5)上述实验完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有_____________________________________________________________。
(6)从棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是__________________,必须使用的仪器是_______________________________。
(7)本实验的产率为60%,则可制取溴乙烷______________g。
(8)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏。为证明最终得到的产品一溴乙烷中含有溴元素,可采取的实验方法是_____________________________
__________________________________________________。
硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为 :4FeS2 + 11O2 ![]()
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:
|
转化率 / % 温度 / ℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
根据上表回答,SO2转化到SO3的最佳反应条件是 。
A.400-500℃ 0.1 MPa B.400℃ 10 MPa
C.500℃ 10 MPa D.400-500℃ 1 MPa
(3)在一定条件下,1mol SO2完全转化成SO3气体时放出热量为Q1 KJ,写出该反应的热化学方程式: 。若在该条件下将2 mol SO2 放入一定容积的密闭容器中,一段时间后测得反应放出热量为Q2 KJ,则此时SO2的转化率为 (用含Q1、Q2代数式表示)。
(4)市售浓硫酸的密度是1.84 g / cm3、质量分数为98 % ,若用H2SO4? XH2O来表示这种浓硫酸,则X为 。
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质.利用明矾石制备氢氧化铝的流程如下:
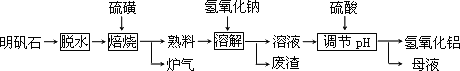
回答下列问题:
(1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S![]() 2Al2O3+9SO2,其中氧化剂为________.
2Al2O3+9SO2,其中氧化剂为________.
(2)“溶解”时反应的离子方程式为________.
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是________.
(4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882 g/L的H2SO4,配制1 L该溶液,需用量筒量取质量分数为98﹪的硫酸(密度是1.8 g/cm3)________mL
(5)“废渣”、“母液”中可回收的物质分别是________.
| ||
压强/MPa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
 2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+
2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+| 1 |
| 2 |
 SO3(g)△H=-Q1 KJ/mol
SO3(g)△H=-Q1 KJ/mol 2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+
2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+| 1 |
| 2 |
 SO3(g)△H=-Q1 KJ/mol
SO3(g)△H=-Q1 KJ/mol| 50Q2 |
| Q1 |
| 50Q2 |
| Q1 |
| 1 |
| 9 |
| 1 |
| 9 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com