
题目列表(包括答案和解析)

| I1/kJ?mol-1 | I2/kJ?mol-1 |
I3/kJ?mol-1 |
I4/kJ?mol-1 |
I5/kJ?mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4—构成,BH4—呈正四面体构型。LiBH4中不存在的作用力有______(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
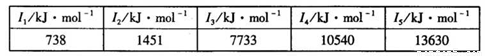
M是______(填元素符号)。
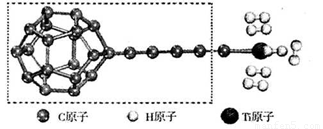
(3)某种新型储氢材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有______种。
(4)分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是______(填标号)。
A.H2O B.CH4 C.HF D.CO(NH2)2
0.200 mol某短周期元素M的单质与足量的盐酸反应,在标准状况下生成6.72 L氢气。等量的M元素的单质与足量的氧气化合,可生成10.2 g M元素的最高价氧化物,M元素中子数比质子数多一个。求M的核电荷数及在元素周期表中的位置。
0.200 mol某短周期元素M的单质与足量的盐酸反应,在标准状况下生成6.72 L氢气。等量的M元素的单质与足量的氧气化合,可生成10.2 g M元素的最高价氧化物,M元素中子数比质子数多一个。求M的核电荷数及在元素周期表中的位置。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com