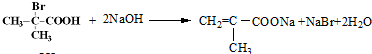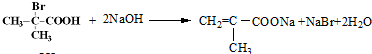氨、肼(N
2H
4)和叠氮酸都是氮元素的重要氢化物.
(1)氨可用于制造氮肥、硝酸等.
①合成氨工业中,“造气”有关反应的热化学方程式如下:
C(s)+H
2O(g)=CO(g)+H
2(g)△H
1=+131.4kJ?mol
-1C(s)+2H
2O(g)=CO
2(g)+2H
2(G)△H
2=+90.2kJ?mol
-1CO(g)+H
2O(g)=CO
2(g)+H
2(g)△H
3则△H
3=
.
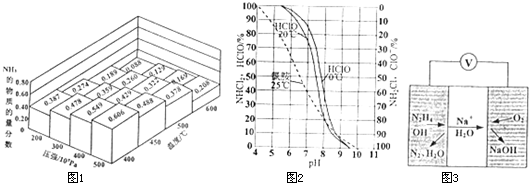
②在一密闭容器中,加入物质的量之比为1:3的N
2与H
2,在不同温度、压强下测得平衡体系中NH
3的物质的量分数如图1所示.则温度为400℃、压强为500×10
5 Pa时,H
2的平衡转化率最接近
(填序号).
A.89% B.75%
C.49% D.34%
③实际生产中,合成氨的温度一般控制在400~500℃,选择该温度范围的理由是
.
④饮用水氯化消毒时若水中含有氨则会产生氯胺(NH
2Cl、NHCl
2等),氯胺水解缓慢释放出HClO,有良好的消毒效果.图2是饮用水氯化消毒时有关成分的含量与pH的关系.下列说法正确的是
(填序号).
A.HCIO在20℃的电离程度一定大于0℃的电离程度
B.pH越大,消毒效果越好
C.用NH
2Cl消毒时,平衡NH
2Cl+H
2O?NH
3+HClO向右移动
(2)肼可用于火箭燃料、制药原料等.
①次氯酸钠与过量的氨反应可以制备肼,该反应的化学方程式为
.
②一种肼燃料电池的工作原理如图3所示.该电池工作时负极的电极反应式为
.
③肼与亚硝酸(HNO
2)反应可生成叠氮酸.8.6g叠氮酸完全分解可放出6.72L氮气(标准状况下),则叠氮酸的分子式为
.

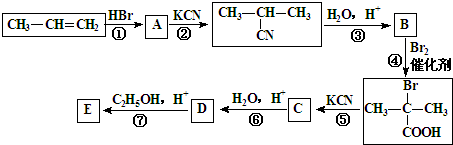
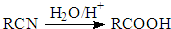
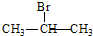
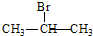
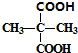 +2C2H5OH
+2C2H5OH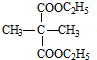 +2H2O
+2H2O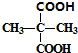 +2C2H5OH
+2C2H5OH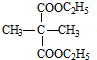 +2H2O
+2H2O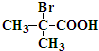 与足量NaOH溶液反应的化学方程式为
与足量NaOH溶液反应的化学方程式为