
题目列表(包括答案和解析)
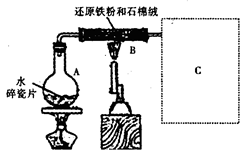
某校化学小组学生利用下图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去).
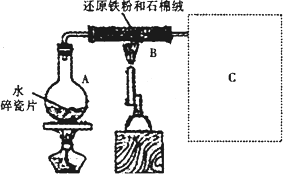
1.装置B中发生反应的化学方程式是________.
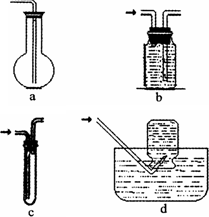
2.虚线框图C的气体收集装置是下图中的________(选填字母编号).
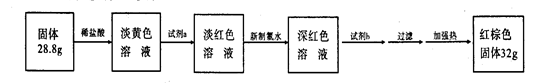
3.反应停止,待B管冷却后,称量,得到固体质量为28.8 g.再向固体中加入过量稀盐酸充分反应,并进行如下实验:
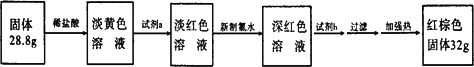
试剂a的化学式是________,试剂b的化学式是________;加入新制氯水后溶液红色加深的原因是(用离子方程式表示)________.
4.某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究.首先提出假设.假设1:溶液中的+3价铁被氧化为更高的价态;假设2:________;为了对所提出的假设2进行验证,实验方案是________.
5.根据所给数据,可计算出反应后B装置中铁元素的质量分数为________.
某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。

(1)装置B中发生反应的化学方程式是 。
(2)虚线框图C的气体收集装置是下图中的 (选填字母编号)。

(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g。再向固体中加入过量稀盐酸充分反应,并进行如下实验:

试剂a的化学式是 ,试剂b的化学式是 ;加入新制氯水后溶液红色加深的原因是(用离子方程式表示) 。
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究。首先提出假设。假设1:溶液中的+3价铁被氧化为更高的价态;假设2:
;为了对所提出的假设2进行验证,实验方案是
。
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为 。
某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。
(1)装置B中发生反应的化学方程式是 。
(2)虚线框图C的气体收集装置是下图中的 (选填字母编号)。
(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g。再向固体中加入过量稀盐酸充分反应,并进行如下实验: 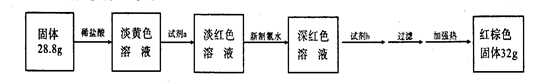
试剂a的化学式是 ,试剂b的化学式是 ;加入新制氯水后溶液红色加深的原因是(用离子方程式表示) 。
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究。首先提出假设。假设1:溶液中的+3价铁被氧化为更高的价态;假设2:
;为了对所提出的假设2进行验证,实验方案是
。
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为 。
| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com