
题目列表(包括答案和解析)
我省合肥市大力发展清洁能源产业,以太阳能为代表的新能源产业规模占全省的一半以上.试完成下列问题:
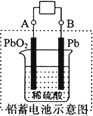
(1)现在电瓶车所用电池一般为铅蓄电池,如图所示,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO![]()
![]() 2PbSO4+2H2O.则电池放电时,溶液的pH会________(填“增大”或“减小”),写出负极反应式为________充电时,铅蓄电池的负极应与充电器电源的________极相连.
2PbSO4+2H2O.则电池放电时,溶液的pH会________(填“增大”或“减小”),写出负极反应式为________充电时,铅蓄电池的负极应与充电器电源的________极相连.
(2)为体现节能减排的理念,中国研制出了新型燃料电池汽车,该车装有“绿色心脏”——质子交换膜燃料电池.下图是某种质子交换膜燃料电池原理示意图.该电池的正极是________(填“a”或“b”,下同)极,工作过程中,质子(H+)透过质子交换膜移动到________极.写出该电池的负极反应式为:________.

(3)最近,合肥开工建设大型太阳能电池板材料生产基地,这种材料主要是高纯度的硅,下面关于硅的叙述中,正确的是________.
A.硅的非金属性比碳弱,只有在高温下才能跟氢气起化合反应
B.SiO2与碳酸钠固体高温条件下反应,说明硅酸的酸性强于碳酸
C.SiO2是酸性氧化物,它不溶于任何酸
D.虽然硅的化学性质不活泼,但在自然界中以化合态存在
E.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
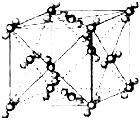 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如图所示.E的电负性在该周期中最大.镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如图所示.E的电负性在该周期中最大.镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.| 两性氢氧化物 | Al(OH)3 | Ga(OH)3 |
| 酸式电离常数Kia | 2×10-11 | 1×10-7 |
| 碱式电离常数Kib | 1.3×10-33 | 1.4×10-34 |
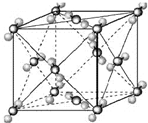 (2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
(2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com