
题目列表(包括答案和解析)
 KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.

| 0.082 |
| 0.06×0.182 |
| 0.082 |
| 0.06×0.182 |
漂白粉在溶液中存在下列平衡:ClO- + H2O  HClO + OH-,下列措施能提高漂白效果的是( )
HClO + OH-,下列措施能提高漂白效果的是( )
| A.加水稀释 | B.加入适量NaOH | C.通入少量SO2 | D.加入适量盐酸 |
漂白粉在溶液中存在下列平衡:ClO- +
H2O 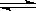 HClO
+ OH-,下列措施能提高漂白效果的是(
)
HClO
+ OH-,下列措施能提高漂白效果的是(
)
A、加水稀释 B、加入适量NaOH C、通入少量SO2 D、加入适量盐酸
漂白粉在溶液中存在下列平衡ClO-+H2O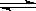 HClO+OH-,下列措施能提高其漂白效益的是(
)
HClO+OH-,下列措施能提高其漂白效益的是(
)
A.加水稀释 B.通入CO2 C.加适量盐酸 D.加少量NaHCO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com