
题目列表(包括答案和解析)
实验室配制80 mL 0.1 mol/L的FeSO4溶液,请回答以下问题.
(1)请画出实验用到的最主要的仪器.
(2)实验中用托盘天平称量的绿矾(FeSO4·7H2O)的质量为________.
(3)定容的操作是________.
(4)分析以下操作对配制的溶液浓度造成的影响(填“偏高”、“无影响”、“偏低”)
①蒸馏水洗完容量瓶后没有烘干________
②转移溶液过程中出现漏液________
③未用蒸馏水洗涤烧杯________
④定容时俯视(视线偏高)________
⑤摇匀后发现液面降低,再加蒸馏水________
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 4.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 反应结束 |
| 2.0mol/L硫酸 | 无明显现象 | 极少量气泡 | 少量气泡 | ||
| 4.0mol/L硫酸 | 无明显现象 | 少量气泡 | 有比较连续的气泡 | ||
 请回答:
请回答:| 实验目的 | 实验 编号 |
温度 | 金属铝 形态 |
盐酸浓度 /mol?L-1 |
| (1)实验①和②探究盐酸浓度对该反应速率的影响; (2)实验①和③探究温度对该反应速率的影响; (3)实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响. |
① | 25?C | 铝片 | 4.0 |
| ② | 25?C 25?C |
铝片 铝片 |
2.0 2.0 | |
| ③ | 35℃ 35℃ |
铝片 铝片 |
4.0 4.0 | |
| ④ | 25?C 25?C |
铝粉 铝粉 |
4.0 4.0 |
| 1 |
| 2 |


 ,负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-═Cu
,负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-═Cu ,负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-═Cu
,负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-═Cu 为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案: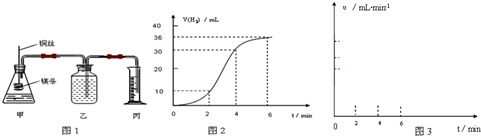
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com