
题目列表(包括答案和解析)
I .如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.


(1) 选用A装置可制取的气体有 ,选用B装置可制取的气有 ,
通常选用C装置制取的气体有 。
(2) 写出利用上述有关药品制取氨气的化学方程式: 。
若要制得干燥的氨气,可选用下列干燥剂中的 (填序号)
a. 生石灰 b. 浓硫酸 C. 五氧化二磷 d. .碱石灰
II. (3) 实验室制取的一氧化氮气体利用右图装置选用必要试剂如何进行收集?
。
III.(4) 现安装一套实验室利用液一液反应制备气体的装置。有人设计了五步操作,请你安排出正确而简捷的程序,将序号填入括号内。
( )将蒸馏烧瓶固定在铁架台上。
( )把酒精灯放在铁架台上,根据酒精灯确定铁圈的高度,固定铁圈,放好石棉网。
( )用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集器中。
( )检查装置的气密性(利用对固定装置进行微热的方法来检查气密性,假定瓶口漏气而需要更换橡皮塞)。
( )在蒸馏烧瓶上装好分液漏斗,连接好导气管。
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如右图所示)。
 (1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
①判定甲方案不可行,理由是 。
②进行乙方案实验:准确量取残余清液稀释一定的倍数后作为试样。
a.量取试样20.00mL,用0.1000 mol·L—1NaOH标准溶液滴定,消耗22.00mL,该次滴定测的试样中盐酸浓度为 mol·L—1;
b.平行滴定后获得实验结果。
 ③判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
③判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3)=2.8×![]() 、Ksp(MnCO3)=2.3×
、Ksp(MnCO3)=2.3×![]() ]
]
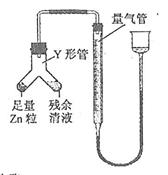
④进行丁方案实验:装置如右图所示(夹持器具已略去)。
(i)使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变。气体体积逐次减小的原因
是 (排除仪器和实验操作的影响因素)。
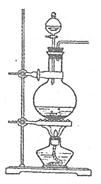
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如右图所示)。
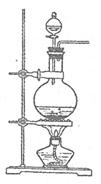 (1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)
A.往烧瓶中加人MnO2粉末 B.加热 C.往烧瓶中加人浓盐酸
 (2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是 。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为 mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3 ) = 2.8×10-9、Ksp(MnCO3 ) = 2.3×10-11
④ 进行丁方案实验:装置如右图所示(夹持器具已略去)。
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将 转移到
中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)。
(12分)为探索工业废料的再利用,某化学兴趣小组设计了如下图所示实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
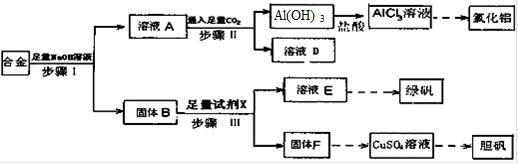
请回答:
(1)步骤I、II、III中均需进行的实验操作是 。
(2)溶液D中的离子主要有 ;试剂X是 。
(3)进行步骤II时,该小组用右图装置及试剂将制得的CO2通入溶液A中,一段时间后,观察到烧杯中产生的Al(OH)3沉淀逐渐减少,其原因是 (用离子方程式表示);为了避免Al(OH)3沉淀减少,根据右图所示,改进的措施是 。
(4)从氧化还原反应和环保角度考虑,用F制备CuSO4时需要氧气和硫酸共同参与,对应的化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com