
题目列表(包括答案和解析)
 Ⅰ.下列实验操作或对实验事实的描述不正确的是
Ⅰ.下列实验操作或对实验事实的描述不正确的是| 滴定次数 | 标准溶液体积/mL | 待测溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20.00 | 1.50 | 23.70 |
| 2 | 20.00 | 1.02 | 21.03 |
| 3 | 20.00 | 2.00 | 21.99 |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另外加少量MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0 (另加少量可溶于水MnSO4粉末) |
2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
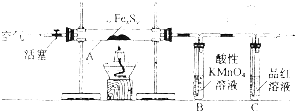
| 液氨 |
| C2H5OC2H5 |
(12分)(1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略)。
①写出制备阿司匹林的化学方程式 。
可用重结晶提纯法提纯阿司匹林。方法如下:
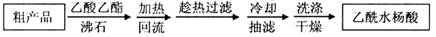
加热回流的装置如图所示:
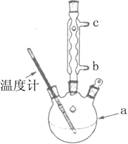
②使用温度计的目的是 。
③冷凝水的流进方向是 。(填“b”或“c”)。
④重结晶提纯法所得产品的有机杂质较少的原因 。
检验产品中是否含有水杨酸的化学方法是 。
(2)氯化苄(C6H5CH2Cl)也是一种重要的有机化工原料。工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄。为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品(含甲苯)进行纯度检测。每一组检测按照如下步骤进行:
A.称取0.300 g样品。
B.将样品与25 mL 4 mol·L-lNaOH溶液在三颈烧瓶中混合,水浴加热回流l小时后停止加热(发生的反应为:C6H5CH2Cl+NaOH→C6H5CH2OH+ NaCl)。
C.在三颈烧瓶中加入50 mL 2 mol·L-l HNO3,混合均匀。
D.将三颈烧瓶中溶液全部转移到100 mL容量瓶中,加水定容。
E.从容量瓶中取出25.00 mL溶液于锥形瓶中,加入6.00 mL 0.100 mol·L-1AgNO3溶液,振荡混合均匀。
F.在锥形瓶中滴入几滴NH4Fe(SO4)2溶液作为指示剂,用0.0250 mol·L-1 NH4SCN溶液滴定剩余的AgNO3。
G.重复E、F步骤三次,消耗0.0250 mol·L1NH4SCN溶液的平均值为4.00mL。
(已知:NH4SCN+ AgNO3= AgSCN↓+NH4NO3)根据以上实验信息回答下列相关问题:
①C步骤所加硝酸的目的是 。
②在F步骤操作中,判断达到滴定终点的现象是 。
③该产品的纯度为 。(请保留2位小数)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com