某研究性学习小组对NaHCO
3溶液进行如下探究.
Ⅰ探究NaHCO
3溶液在不同温度下pH变化的原因
(1)小组同学测得饱和NaHCO
3溶液在不同温度下的pH如下:
| 温度/℃ |
10 |
20 |
30 |
加热煮沸后冷却至 50℃ |
pH |
8.3 |
8.4 |
8.5 |
8.8 |
分析上述溶液pH增大的原因:
①甲同学认为是温度升高促进了HCO
3-的水解,溶液pH增大.写出HCO
3-水解的离子方程式:
.
②乙同学认为溶液pH增大的原因还与NaHCO
3在水溶液中受热分解产生Na
2CO
3有关.Na
2CO
3水解程度
(填“大于”或“小于”)NaHCO
3.
③丙同学为验证甲、乙两同学的观点,进行了如下实验:
实验1:将加热后的溶液冷却至 10℃,测得此时溶液pH大于8.3;
实验2:在加热煮沸后已冷却的溶液中加入足量的试剂X,产生沉淀.
分析上述验证实验,可说明乙同学观点是
(填“合理”或“不合理”)的.
实验2中试剂X是
.
A.Ba(OH)
2溶液 B.BaCl
2溶液 C.NaOH溶液 D.澄清石灰水
Ⅱ配制1.00mol?L
-1NaHCO
3溶液,测定其分解率
(2)配制1.00mol?L
-1NaHCO
3溶液100mL.容量瓶上可以看到的标记是
.
A.温度 B.容量 C.刻度线 D.溶液物质的量浓度
(3)小组同学取室温下已敞口放置一段时间的上述NaHCO
3溶液50.00mL,与足量的稀盐酸反应,测定产生CO
2的量,设计了如下装置.
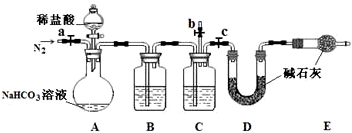
①上述装置C中盛装的试剂为
.
②往A中加入稀盐酸前,为赶出装置中的空气,先通入N
2一段时间.此过程应进行的操作是
.
③若实验测得D装置增重 2.14g,则溶液中NaHCO
3的分解率是
.

