
题目列表(包括答案和解析)
合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
① CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
② CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3 kJ/mol
2CO(g)+2H2(g) ΔH2=+247.3 kJ/mol
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
⑴ 在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示。反应进行的前5 min内, v(H2)= ▲ ;10 min时,改变的外界条件可能是 ▲ 。
|

⑵ 如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。

⑶ 反应③中ΔH3= ▲ 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系式是 ▲ (填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 如图2 | ||
| 2 | 23.97 | 23.97 | |
| 3 | 24.03 | 24.03 | |
高中化学教材中有如图1所示的铜与浓硫酸反应的实验装置,该实验过程中会有二氧化硫气体放出,污染室内空气,严重地损害师生健康.为此,某课外小组对此实验进行如图2所示的改进,改进的实验操作简单、现象明显,并且几乎无二氧化硫气体泄漏.实验步骤如下:

①首先按装置图2安装仪器,安装仪器时,在支管胶塞的铁丝钩上挂一片品红试纸.
②向试管中加入约10 mL的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生.等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了.
回答下列问题:
(1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有________.
(2)塑料袋的作用是________.
(3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是________,相关反应的离子方程式是________.
12分)立方氮化硼(cBN)是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,但耐热性、化学稳定性以及钢材加工等方面表现出比金刚石更加优异的性能,具有巨大的应用价值。由美国通用电气公司温托夫等人首次研制成功,随后成为各国争相研制的热点,是超硬材料领域的最重要成就之一。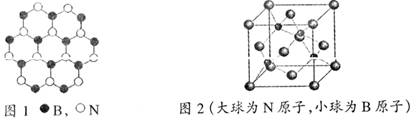
10-1 立方氮化硼由六方氮化硼(hBN)在高温高压下制备,六方氮化硼又称“白石墨”,结构和许多性质与石墨类似,柔软光滑,由如图1所示的B、N平面层堆叠形成,沿c轴方向相邻两层的B、N原子投影重合,试画出hBN的一个晶胞透视图。
10-2 立方氮化硼(cBN)的晶胞结构如图2所示,与金刚石的结构相似,面心立方晶胞,晶胞参数α = 361.5 pm。在cBN晶体中B原子的堆积方式为______,B填充N的_____空隙
10-3 宝石工匠琢磨钻石时,有些晶面特别难抛光,试推测立方氮化硼的那些晶面难抛光?为什么?_____________________________________________________________________ ___________________________________________________________________________
10-4 以知金刚石的晶胞参数α = 356.7 pm,通过计算说明立方氮化硼的硬度略小于金刚石的原因。
计算过程:_________________________________________________________________
___________________________________________________________________________
解释原因:_________________________________________________________________
___________________________________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com