
题目列表(包括答案和解析)
中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体。(图中部分产物和反应条件已略去)
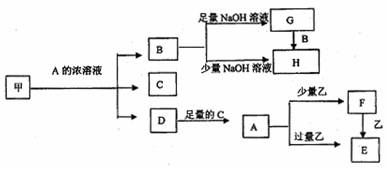
回答下列问题:
(1)写出甲与A的浓溶液反应的化学方程式_______________ ;
(2)C的电子式是 ________________;
(3)除去G固体中含有H杂质采用的方法是_______________;
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝的气体反应,生成一种盐,该盐的溶液呈酸性,其原因是(用离子方程式表示)_____________________;
(5)写出由F转化为E的离子方程式____________ ;将溶液F加热蒸干、灼烧到质量不再减少时所得固体物质的化学式为_______________;
(6)4g单质甲燃烧能放出131.17kJ的热量,写出单质甲燃烧热的热化学方程式_______;



| ||
| ||
| 5 |
| 2 |
| 5 |
| 2 |
(15分)中学化学常见部分元素原子结构及性质如下表所示:
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | B原子K、L、M层电子数之比是1:4:1 |
| ③ | C | C是活泼非金属元素,其单质常温下呈气态但化学性质稳定 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料[来源:Z*xx*k.Com] |
| ⑤ | E | 通常情况下,E没有正化合价,A、C、F都能与E形成二种或二种以上化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
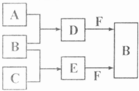 试回答:
试回答:

A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体,F是由两种短周期元素构成的离子化合物,其转化关系如图 (反应条件和部分产物略去)。试回答:
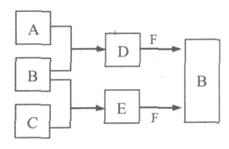
(1) F的电子式是 。
(2)写出E与F反应生成B的化学方程式,并用双线桥标出电子转移的方向与数目
(3) 单质X和B或D均能反应生成黑色固体Y,Y与盐酸反应的离子方程式是 。若固体恰好溶解,则所得溶液呈 性。
(4) 物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(5) 取0.3 mol F与足量D充分混合后,所得溶液中再通入0.4 mol E充分反应,最后得到产物的物质的量比为 。(不考虑水解)
(6) E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。
(已知甲醇的燃烧热![]() ,氢气的燃烧热
,氢气的燃烧热![]() )
)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com