
题目列表(包括答案和解析)
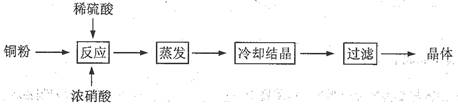
(13分) CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象: 、 。
(2)有同学认为此种方法会生成有毒的氮的氧化物, 且所得晶体可能混有硝酸铜。建议将浓硝酸换成其它氧化剂,你觉得呢?若有同感,请选择合适的试剂完成下列反应(若有反应条件的应注明):
__Cu + __H2SO4 + __________→ __CuSO4 +_______________
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
相对分子质量:CuSO4:160 H2O:18
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则该试样中含CuSO4·5H2O的质量分数为 。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。
(5)如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
①称取样品a g②加水溶解③加氯化钡溶液,沉淀④过滤、 、干燥⑤称量所得固体b g。
在过滤前,需要检验是否沉淀完全,其操作是
则a g该试样中含CuSO4·5H2O的质量为 g (用含b的代数式表示)。
[相对原子质量:H-1 O-16 S-32 Ba-137]
(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的500 mL稀硝酸中微热,产生1.12 L气体(标准状况),则样品①中氧化铜的质量为 g。若金属铜恰好全部溶解,稀硝酸也恰好全部反应,则没有被还原的硝酸的物质的量为 mol。?
(2)乙取样品②a g强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为? ?。样品②中氧化铜质量为 g(用含a、b的代数式?表示)。??
(3)丙称量样品③强热后剩余的固体,其质量比原样品减少了c g,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为 。?
(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12L气体(标准状况),则样品①中氧化铜的质量为________g.
(2)乙取样品②a g强热,生成的气体不能使澄清的石灰水变浑浊.再将反应后的固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为________________.样品②中氧化铜质量为________________g(以含a、b的代数式表示).
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了c g,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为________________.
(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12L气体(标准状况),则样品①中氧化铜的质量为________g.
(2)乙取样品②ag强热,生成的气体不能使澄清的石灰水变浑浊.再取反应后的固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为________.样品②中氧化铜质量为________g(以含a、b的代数式表示).
(3)丙称量样品③强热后剩余的固体,质量比原样品减少了cg,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为________.
已知两反应物的量,先判断过量再作计算.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com