
题目列表(包括答案和解析)
空气质量越来越受到人们的关注,下表是我省部分城市空气质量周报:
城市 污染指数 首要污染物 空气质量等级
济南 98 SO2 Ⅱ
青岛 47 Ⅰ
淄博 103 TSP Ⅲ
潍坊 90 NOx Ⅱ
注:TSP—总悬浮颗粒物;NOx—氮氧化物
(1)由上表可知,最容易出现酸雨的城市是________。
(2)悬浮颗粒不易沉降,它与空气中的SO2、O2接触时,SO2会部分转化为SO3,悬浮颗粒物所起的作用是________。(填序号)
A.氧化剂 B.还原剂
C.催化剂 D.吸附剂
(3)氮的氧化物也是大气污染物之一。目前,治理NO的方法是在一定条件下用氨把一氧化氮还原为氮气和水。科学家又设想,在相同条件下可采用价格比NH3更便宜的天然气来处理NO,可得到同样效果,写出该反应的化学方程式_________________________________________________________________________。
(4)某中等城市每年燃煤约3´106t,其含硫量按1.00%计算,若硫全部转化为SO2,SO2有60.0%转化为硫酸,相当于生成多少吨98.0%的硫酸?
(列式计算)
城市 污染指数 首要污染物 空气质量等级
济南 98 SO2 Ⅱ
青岛 47 Ⅰ
淄博 103 TSP Ⅲ
潍坊 90 NOx Ⅱ
注:TSP—总悬浮颗粒物;NOx—氮氧化物
(1)由上表可知,最容易出现酸雨的城市是________。
(2)悬浮颗粒不易沉降,它与空气中的SO2、O2接触时,SO2会部分转化为SO3,悬浮颗粒物所起的作用是________。(填序号)
A.氧化剂 B.还原剂
C.催化剂 D.吸附剂
(3)氮的氧化物也是大气污染物之一。目前,治理NO的方法是在一定条件下用氨把一氧化氮还原为氮气和水。科学家又设想,在相同条件下可采用价格比NH3更便宜的天然气来处理NO,可得到同样效果,写出该反应的化学方程式_________________________________________________________________________。
(4)某中等城市每年燃煤约3´106t,其含硫量按1.00%计算,若硫全部转化为SO2,SO2有60.0%转化为硫酸,相当于生成多少吨98.0%的硫酸?
(列式计算)

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下
6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
(4)测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
快乐是什么?精神病学专家通过实验发现:在大脑的相应部位——“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态.人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.
多巴胺结构如右图: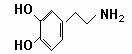
(1)多巴胺分子式: .
(2)试判断多巴胺能发生的化学反应 .
A.加成 B.取代 C.氧化 D.水解
(3)写出与多巴胺互为同分异构体且满足下列三个条件的所有物质的结构简式:
① 属于1、3、5三取代苯 ② 苯环上直接连有一个羟基和一个氨基
③ 分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2:1
.
(4)多巴胺可由香兰素与硝基甲烷缩合,再经锌汞齐还原水解而得.合成过程表示如下:
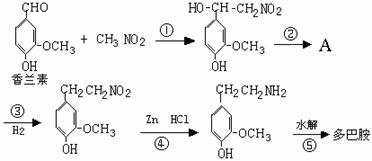
(Ⅰ) 写出下列反应类型:反应① ,反应⑤ .
(Ⅱ) A的结构简式: .
(Ⅲ) 写出②的化学方程式: .
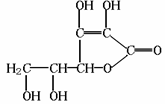
维生素C是一种水溶性维生素(其水溶液呈酸性),又称抗坏血酸,化学式为C6H8O6,结构如下图所示。维生素C易被空气中的氧气氧化。下列关于维生素C的叙述错误的是 ( )
A.维生素C能使溴水褪色
B.维生素C可发生酯化反应
C.维生素C不能发生水解反应
D.维生素C具有还原性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com