
题目列表(包括答案和解析)
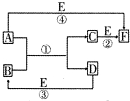 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物均未列出).
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物均未列出).

[2012·西安交大附中一模](10分)在学习了硝酸的强氧化性后,某学习小组进行了浓硝酸和硫单质反应的实验探究。他们根据氧化还原反应原理推测硫的氧化产物,提出三种假设:
I.只有H2SO4;
II.只有SO2;
III.SO2和H2SO4都有。
为了探究是哪一种情况,他们设计了下列实验流程及步骤:

①混合气体用水全部吸收后,测得无含硫、含氮化合物逸出,并将吸收液配成100.00mL溶液。
②取①中所得溶液20.00mL,加足量BaCl2溶液得白色沉淀0.466 g。
③再取20.00mL①中所得溶液,用NaOH溶液中和,恰好用去0.6 mol/LNaOH溶液30.00 mL。
请回答下列问题:
(1)混合气体中NO2气体被水充分吸收的反应方程式为__________ ____。
(2)①中配制溶液所用到的玻璃仪器除烧杯、量筒外还有______________;配制的100.00 mL溶液中H+的物质的量浓度是__________。
(3)收集到的气体中含有____ ___,假设_______(填“I、II或III”)成立;该实验中浓硝酸和硫反应的化学方程式为_____________________。
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出)。
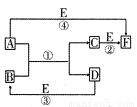
(1)若A、D、E是短周期的非金属单质,且 A、D所含元素同主族,A、E含元素同周期,已知D单质在电子工业中有重要作用,则D的原子结构示意图为________;F的分子构型为________;反应①的化学方程式为__________________。
(2)若A、D为常见金属单质,且加热时A、D才能溶解在E的浓溶液中,写出反应③的化学方程式_ _________________;足量的A与B溶液充分反应后,生成物C中金属阳离子的检验方法为__________________;若以惰性电极电解B的水溶液,当阴极增重9.6g时,阳极生成气体在标准状况下的体积为________,写出电解B的水溶液的离子方程式__________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com