
题目列表(包括答案和解析)
 某同学在气体体积测定仪中用镁和硫酸反应测定1mol氢气体积.完成下列填空:
某同学在气体体积测定仪中用镁和硫酸反应测定1mol氢气体积.完成下列填空:某同学在气体体积测定仪中用镁和硫酸反应测定1 mol氢气体积。完成下列填空:
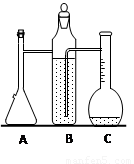
(1)A中发生反应的离子方程式为______________________。
(2)检查装置气密性的方法是塞上B瓶的玻璃塞,用橡皮塞塞紧A瓶加料口,当看到__________________现象时,可以确认装置气密性良好。
(3)已知液体量瓶的刻度范围是110~130 mL,实验时称取镁带的质量要控制在0.100~0.110 g之间,目的是_________。
(4)完成一次测定实验,需要2次用注射器抽气,其中需要记录的是第__________次抽出气体的体积。
(5)下列情况会导致实验结果偏高的是______(填编号)
a. 镁表面的氧化膜没有除尽 b. 储液瓶中的液体是水
c. 未冷却到室温就读数 d. 装置气密性不好
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 |
若溶液颜色明显改变,且有 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体与试管中,滴加 |
草酸亚铁(FeC2O4•2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
I.兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:________; 假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3。
限选试剂: 1.0 mol•L-1盐酸、3% H2O2、0.1 mol•L-1CuSO4、20% KSCN、蒸馏水。
|
实验步骤 |
现象与结论 |
|
步骤1 :向试管中加入少量固体产物,再加入足量_________________,充分振荡 |
若溶液颜色明显改变,且有_______生成,则证明有铁单质存在 |
|
步骤2: 将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 |
|
|
步骤3:取步骤2得到的少量固体与试管中, 滴加___________________________________ _______________________________________
|
__________________________________ ___________________________________
|
II.某草酸亚铁样品中含有少量草酸(为方便于计算,草酸亚铁中草酸根和草酸分子均用C2O42-代替)。现用滴定法测定该样品中FeC2O4的含量。滴定反应分别是:5Fe2++MnO4-+8H+=5Fe3+ +Mn2++4H2O、5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。
(3)实验方案设计为:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V2 mL。
③若某小组的一次测定数据记录如下: V1= 18.90mL,V2=6.20mL。根据数据计算0.20g 样品中:n(Fe2+)= ; n(C2O42-)= ;FeC2O4 的质量分数为 (精确到0.01%,FeC2O4的式量为144)
某工厂的废液经测定得知主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。现欲从废液中回收乙醇和乙酸,根据各物质的沸点,补充下列实验步骤,模拟实现这一过程,并回答有关问题。
|
物质 |
丙酮( |
乙酸乙酯 |
乙醇 |
乙酸 |
|
沸点/℃ |
56.2 |
77.06 |
78 |
117.2 |
可供选择的实验用品:
1 mol·L-1烧碱溶液,18.4 mol·L-1硫酸,蒸馏水和冰,400 mL烧杯,250 mL烧杯,250 mL蒸馏烧瓶,温度计,冷凝器,接收器,玻璃棒以及中学化学实验的常用仪器。
(1)补充下列实验步骤:
①组装蒸馏装置,检查气密性;
②取100 mL废液注入250 mL蒸馏烧瓶中,滴入1 mol·L-1烧碱溶液,调至废液pH=10;
③________________________________________________________________________;
④________________________________________________________________________;
⑤________________________________________________________________________;
⑥________________________________________________________________________。
(2)滴入1 mol·L-1烧碱溶液,使溶液的pH=10的目的是
________________________________________________________________________。
(3)用18.4 mol·L-1硫酸的目的是(用化学方程式表示)
________________________________________________________________________。
(4)最后蒸馏烧瓶内残留液中的溶质的主要成分是________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com