
题目列表(包括答案和解析)
 ?
?
(1)在实验室用集气瓶收集气体G和气体H。则收集气体G的方法是 ,检验气体H已收集满的方法是 。?
(2)在实验室进行操作①时,除了使用酒精灯、铁架台、铁圈及夹持仪器外,还缺少的玻璃仪器是 ,在进行操作②时,应在HCl的气氛中加热脱水,其目的是 。?
(3)F位于元素周期表第? ?周期? ?族,写出其最高价氧化物对应的水化物的电子式? ?。写出反应A+H2O→B+H的化学方程式 。?
(4)某学生设计如图15-38装置,将产生的气体H通入硫酸铜溶液,制得深蓝色溶液J。现有下列?试剂?:?
 ?
?
图15-38
①稀NaOH溶液 ②H2O2溶液 ?③浓氨水 ?④NH4Cl?溶液 ⑤生石灰 ?⑥消石灰 ⑦碳酸氢钠?
(Ⅰ)a中的试剂:固体X应是? ?(填序号),溶液Y应是 (填序号)。
(Ⅱ)你认为使用装置b时存在的主要缺点: (用简明文字叙述)。?
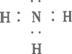
(1)在实验室用集气瓶收集气体G和气体H。则收集气体G的方法是(写一种):__________
__________;检验气体H已收集满的方法是:__________。
(2)在实验室进行操作①时,除了使用酒精灯、铁圈、铁架台及夹持仪器外,还缺少的仪器是:____________;在进行操作②时,应在HCl的气氛中加热脱水,其目的是:__________。
(3)A+H2O![]() B+H的基本反应类型为__________,H的电子式为__________。
B+H的基本反应类型为__________,H的电子式为__________。
(4)如下图所示支管中,左管中放入MnO4固体,右管中放入小块钠,再向两管均加入适量8 mol·L-1的盐酸,半分钟后,盖上橡胶塞并将此支管固定在铁架台上。用一照相机对准此支管,按快门,闪光灯闪亮。请回答:
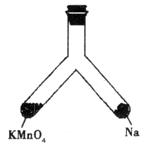
①“照相”之前,左管中反应生成的气体是__________(写化学式),若生成0.5 mol该气体,则转移电子的物质的量是__________mol。
②“照相”时,灯光闪亮,支管随之出现的现象是__________。
化合物A由两种不同短周期元素X、Y组成,具有良好电绝缘性。w.w.w.k.s.5.u.c.o.m
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为 。
(2)0.1 mol/L X的硫酸盐溶液与0.1 mol/L NaOH溶液等体积混合,反应的离子方程式为
(3)Y的单质在放电条件下能与氧气反应。写出化学方程式:
。
(4)化合物A能与水缓慢反应生成含Y的化合物Z,Z分子中含有10个电子。写出该反应的化学方程式: 。
(5)工业用X的单质和化合物Z在高于1700K反应制备A。已知该反应可以认为是置换反应,该反应的化学方程式是 。
| (c+d) | 2 |




 短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com