
研究性学习小组为探究Cu与浓H
2SO
4反应及其产物SO
2的性质,设计如下实验装置:
(1)写出铜与浓硫酸反应的化学方程式:
Cu+2H
2SO
4(浓)
CuSO
4+SO
2+2H
2O
Cu+2H
2SO
4(浓)
CuSO
4+SO
2+2H
2O
;浸有碱液的棉花的作用是:
吸收SO2防止污染空气
吸收SO2防止污染空气
.
(2)该小组同学在实验中发现以上实验装置有相当多不足之处,如实验不够安全和易造成环境污染等.为改进实验和更多地了解SO
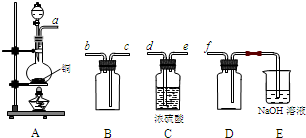
2的性质,经过同学间的讨论和与老师的交流,设计了如图实验装置.

①对试管A中的浓H
2SO
4和铜丝进行加热,发现E试管中有气泡逸出,品红溶液 很快褪色,但最终 未见D试管中氢氧化钡溶液出现浑浊.为探究D试管中未出现浑浊的原因,该小组同学在化学手册中只查阅到下列物质常温下的溶解度数据:
| 物质 |
溶解度(g/100水) |
物质 |
溶解度(g/100水) |
| Ca(OH)2 |
0.173 |
Ba(OH)2 |
3.89 |
| CaCO3 |
0.0013 |
BaSO3 |
0.016 |
| Ca(HCO3)2 |
16.60 |
|
|
他们应用类比研究方法预测了D试管未出现浑浊的原因:
生成了溶解度较大的Ba(HSO3)2
生成了溶解度较大的Ba(HSO3)2
.
②为验证D试管中溶液的组成,进行了下列实验,请你帮他们完成实验报告.
| 实验方案 |
现象 |
| 1取少量溶液于试管中,加入氢氧化钠溶液 |
|
| 2取少量溶液于试管中,加入稀盐酸,加热,用湿润的蓝色石蕊试纸检验生成的气体. |
|
(3)实验结束后,发现试管A中还有铜片剩余.该小组的同学根据所学的化学知识认为硫酸也有剩余.下列药品中能够用来证明反应结束后的试管A中确有余酸的是
A D
A D
(填写字母编号).
A.铝粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(4)请写出长导管B的作用
防止C中的液体倒吸(或检验反应时导管是否堵塞或拆卸装置前从B管口向试管A中大量鼓入空气,
以排尽A中的二氧化硫气体,不会产生污染等)
防止C中的液体倒吸(或检验反应时导管是否堵塞或拆卸装置前从B管口向试管A中大量鼓入空气,
以排尽A中的二氧化硫气体,不会产生污染等)
(只写一点就可).

 如图.在一支试管中放入一小块铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.
如图.在一支试管中放入一小块铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.
 研究性学习小组为探究Cu与浓H2SO4反应及其产物SO2的性质,设计如下实验装置:
研究性学习小组为探究Cu与浓H2SO4反应及其产物SO2的性质,设计如下实验装置:
 (2012?开封一模)某校化学兴趣小组为研究铜丝与过量浓硫酸的反应及SO2的部分化学性质,进行如下实验.该小组同学在实验中发现使用教材所提供的铜和浓硫酸反应的实验装置不仅安全性差而且易造成环境污染.经过同学们的讨论以及老师的指导,该小组设计了图所示的装置并进行实验.
(2012?开封一模)某校化学兴趣小组为研究铜丝与过量浓硫酸的反应及SO2的部分化学性质,进行如下实验.该小组同学在实验中发现使用教材所提供的铜和浓硫酸反应的实验装置不仅安全性差而且易造成环境污染.经过同学们的讨论以及老师的指导,该小组设计了图所示的装置并进行实验.