
题目列表(包括答案和解析)
普利斯特里(Joseph Priestley)在拉瓦锡之前发现了氧气,但由于受“燃素说”的影响,他把氧气当作了“燃素”。拉瓦锡正是在普利斯特里研究的基础上,破除了“燃素说”的束缚,确认氧气是由一种元素形成的纯净物。普利斯特里在一次加热浓硫酸的实验中,由于不慎,造成了倒吸,将水槽中的水银(Hg)倒吸进加热后的浓硫酸中,并且烧坏了手。偶然中他发现热的浓H2SO4与水银发生了反应并生成了一种气体。这种气体就是由他发现的SO2。根据以上叙述判断下列说法不正确的是( )
A.浓H2SO4具有强腐蚀性,操作应格外小心
B.为防止倒吸,实验结束时应先从水槽中取出导气管,后撤酒精灯
C.实验中应仔细观察,不放过任何异常现象
D.普利斯特里是一位失败的科学家,不值得尊敬
A.浓H2SO4具有强腐蚀性,操作应格外小心
B.为防止倒吸,实验结束时应先从水槽中取出导气管,后撤酒精灯
C.实验中应仔细观察,不放过任何异常现象
D.普利斯特里是一位失败的科学家,不值得尊敬
| 实验操作 | 现象 | 结论 |
| 步骤一: 取萃取后的上层清液滴加2-3滴 K4[Fe(CN)6]溶液 取萃取后的上层清液滴加2-3滴 K4[Fe(CN)6]溶液 |
产生蓝色沉淀 | 猜想一不成立 猜想一不成立 |
| 步骤二: 往探究活动III溶液中加入乙醚,充分振荡 往探究活动III溶液中加入乙醚,充分振荡 |
乙醚层呈血红色 乙醚层呈血红色 |
“猜想二”成立 |
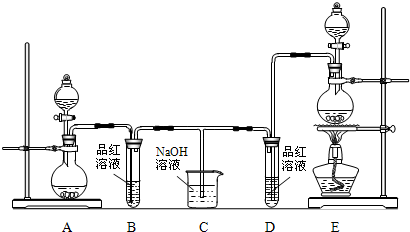
| ||
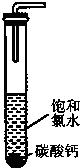 (1)向蓝色石蕊试纸上滴加几滴饱和氯水,发现试纸先变红后变白.要确证使石蕊褪色的物质是次氯酸,还必须要做的实验是
(1)向蓝色石蕊试纸上滴加几滴饱和氯水,发现试纸先变红后变白.要确证使石蕊褪色的物质是次氯酸,还必须要做的实验是湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com