
题目列表(包括答案和解析)
(10分) 1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO |
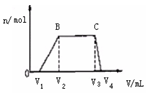
⑴ 往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)
与加入NaOH溶液的体积(V)的关系如右图所示。
则该溶液中一定不含有的离子是_________。
(2)BC段离子方程式为 。
(3)V1 、V2、V3、 V4之间的关系 。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的
Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,
分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为___________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________。
(10分) 莽草酸具有抗炎、镇痛作用,还可作为合成抗病毒和抗癌药物的中间体。莽草酸可以实现下列转化:
已知:①
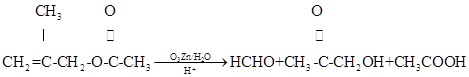
请回答下列问题。
(1)A的结构简式是 。
(2)B![]() C的化学方程式是
C的化学方程式是
。
反应类型是 反应。
(3)在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原予称为手性碳原
子。E分子中手性碳原子有 个。
(4)莽草酸经过中间产物D合成E的目的是 。
(10分)某化学研究性小组在用铝与稀硫酸的反应制氢气的实验时发现,如果把在空气中放置一段时间的5.0 g铝片放入圆底烧瓶中,然后通过分液漏斗加入500 mL 0.5 mol/L硫酸溶液,充分反应后,该小组同学根据记录数据得到了产生氢气的速率与反应时间的关系图象(如图所示) ,请你帮助该小组同学回答下列问题:
(1)曲线OA段不产生氢气的原因是_____________ _ ______
____________________ _____,
有关的离子反应方程式为_________________________ _____ _____
(2)曲线BC段产生氢气的速率突然加快的主要原因是
____________________________________________________________________________
(3)点C以后产生氢气的速率逐渐减小的主要原因是
____________________________________________________________________________
(4)从理论上分析该小组同学能收集到氢气的体积为(标准状况下)___________
(10分) 1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH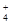 、Fe2+、Fe3+ 、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO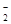 |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
(10分)
(1)在上面元素周期表中全部是金属元素的区域为___________。
| A.a | B.b | C.c | D.d |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com