
题目列表(包括答案和解析)
(13分)下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小题:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在以上表格中所有元素里基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,,则属于s区的元素有 种,属于d区的元素有 种。第二周期元素中除Ne外电负性由高到低的三种元素依次是 ,电离能由高到低的三种元素依次是 。
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| 电离能 ( kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
回答下列问题:
Mn元素的电子排布式为____________________________________,
Fe2+的电子排布图为__________________________
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个 电子难。对此,你的解释是:_____________________________
【解析】(1)考查元素周期表的结构和原子核外电子的排布规律。根据构造原理可知4s轨道上只有1个电子的元素是K、Cr和 Cu。
(2)除ds区外,区的名称来自于构造原理最后填入电子的能级的符号,即s区包括第IA和ⅡA,共2列。p区包括第ⅢA到第 ⅦA以及0族,共6列。D区包括第3列到第10列,共8列。ds区包括第11和12列,共2列。非金属性越强,电负性越大,第一电离能也越大,非金属性是Cl>S>P,所以电负性是Cl>S>P。由于P原子的3p轨道属于半充满,属于第一电离能是Cl>P>S。
(3)根据构造原理可以写出锰元素的电子排布,即1s22s22p63s23p63d54s2,Fe2+的电子排布图为1s22s22p63s23p63d6。由于Mn2+的3d轨道属于半充满,比较稳定,所以再失去1个电子所需要的能量就高。而Fe2+的3d轨道上有6个电子,Fe3+的3d轨道上有5个电子,属于不充满比较稳定,因此3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。
A(6分)生活中常用药品很多,如:①碘酒、②麻黄碱、③青霉素、④阿司匹林、⑤葡萄糖注射液、⑥胃舒平(含氢氧化铝、淀粉等)。
⑴上述物质中属于抗生素的是____ _(填写序号,下同),不属于人工合成药物的是 。
⑵胃舒平可防治胃酸分泌过多,其发挥功效时的离子方程式
为 。
⑶药品生产常选用淀粉作填充剂、粘合剂。服用添加淀粉的药物不会伤害身体的原因是_______________________________________________________________。
⑷低血糖病症发作时,喝葡萄糖水可快速见效。葡萄糖作为营养剂供给人体能量,在体内发生的主要反应是_________(填写字母,下同)。
A.加成反应 B.取代反应 C.氧化反应 D.聚合反应
⑸下列关于药物使用的说法中,正确的是__________。
A.碘酒能使蛋白质变性,常用于外敷消毒
B.长期大量服用阿司匹林可预防疾病,没有毒副作用
C.使用青霉素可直接静脉注射,不需进行皮肤敏感试验
D.随着平价药房的开设,生病都可以到药店自己买药服用医治,不用到医院就诊
四、本大题3题,共21分。
(13分)下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小题:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在以上表格中所有元素里基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,,则属于s区的元素有 种,属于d区的元素有 种。第二周期元素中除Ne外电负性由高到低的三种元素依次是 ,电离能由高到低的三种元素依次是 。
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
|
元素 |
Mn |
Fe |
|
|
电离能 ( kJ·mol-1) |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
回答下列问题:
Mn元素的电子排布式为____________________________________,
Fe2+的电子排布图为__________________________
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个 电子难。对此,你的解释是:_____________________________
【解析】(1)考查元素周期表的结构和原子核外电子的排布规律。根据构造原理可知4s轨道上只有1个电子的元素是K、Cr和 Cu。
(2)除ds区外,区的名称来自于构造原理最后填入电子的能级的符号,即s区包括第IA和ⅡA,共2列。p区包括第ⅢA到第 ⅦA以及0族,共6列。D区包括第3列到第10列,共8列。ds区包括第11和12列,共2列。非金属性越强,电负性越大,第一电离能也越大,非金属性是Cl>S>P,所以电负性是Cl>S>P。由于P原子的3p轨道属于半充满,属于第一电离能是Cl>P>S。
(3)根据构造原理可以写出锰元素的电子排布,即1s22s22p63s23p63d54s2,Fe2+的电子排布图为1s22s22p63s23p63d6。由于Mn2+的3d轨道属于半充满,比较稳定,所以再失去1个电子所需要的能量就高。而Fe2+的3d轨道上有6个电子,Fe3+的3d轨道上有5个电子,属于不充满比较稳定,因此3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。
阅读下面文字,回答1、2题:
吸烟是人类的一种不良嗜好,也是生活环境中的特殊大气污染源,对人体健康危害极大.据分析吸烟生成的物质至少有700多种,其中大部分为有毒物质.危害最大的物质中有两种是尼古丁和苯并芘,前者的成人致死量约40mg~60mg,相当于一包香烟产生的尼古丁的总量;后者是最强的致癌物质之一.它们的结构简式分别是:
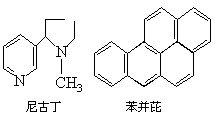
1.对尼古丁和苯并芘的分子组成与结构叙述正确的是_______。
A.尼古丁的分子式为C10H16N2
B.苯并芘的分子式为C20H18
C.尼古丁分子中所有碳原子可能不在同一平面上;苯并芘分子中的所有氢原子都在同一平面上
D.苯并芘分子中含有苯环结构单元,是苯的同系物
2.对尼古丁和苯并芘的性质推测可能错误的是_______。
A.尼古丁分子中的氮原子能与水中的H+结合形成配位键,其水溶液可能呈碱性
B.尼古丁可能既溶于水又溶于有机溶剂,苯并芘只溶于有机溶剂而不溶于水
C.两者固态都属于分子晶体,熔点和沸点不高
D.苯并芘分子能发生硝化反应,其一硝基取代物最多可能有10种
|
(思维拓展题)当A、B两种元素的原子分别获得2个电子形成稳定结构时,A放出的能量大于B放出的能量;当C、D两种元素的原子分别失去1个电子形成稳定结构时,D吸收的能量大于C吸收的能量.A、B、C、D之间分别形成化合物时,属于离子化合物可能性最大的是 | |
| [ ] | |
A. |
D2A |
B. |
C2B |
C. |
C2A |
D. |
D2B |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com